Całkowita synteza strychniny - Strychnine total synthesis
Całkowita synteza strychniny w chemii opisuje całkowitą syntezę złożonej biocząsteczki strychniny . Pierwsza metoda opisana przez grupę Roberta Burnsa Woodwarda w 1954 roku jest uważana za klasyczną w tej dziedzinie badań.
W tym czasie tworzyła naturalny wniosek do skomplikowanego procesu molekularnego określania struktury , która rozpoczęła się z izolacji strychniny od ziaren Strychnos Ignatii przez Pierre Joseph Pelletier i Joseph Bienaimé Caventou w 1818 roku głównych czynników do całego nakładu były Sir Robert Robinson z ponad 250 publikacjami i Hermann Leuchs z kolejnymi 125 artykułami na przestrzeni 40 lat. Robinson otrzymał Nagrodę Nobla w dziedzinie chemii w 1947 za pracę nad alkaloidami, w tym strychniną.
Proces identyfikacji chemicznej został zakończony publikacjami Robinsona w 1946 r., a następnie potwierdzonymi przez Woodwarda w 1947 r. Struktury rentgenowskie ustalające konfigurację absolutną stały się dostępne między 1947 a 1951 r. dzięki publikacji JM Bijvoeta i JH Robertsona .
Woodward opublikował bardzo krótkie sprawozdanie na temat syntezy strychniny w 1954 (tylko 3 strony) i długie (42 strony) w 1963.
Istnieje wiele innych metod, które zostały opisane przez grupy badawcze Magnus, Overman, Kuehne, Rawal, Bosch, Vollhardt, Mori, Shibasaki, Li, Fukuyama Vanderwal i MacMillan. Znana jest również syntetyczna (+)-strychnina. Syntezy racemiczne zostały opublikowane przez Padwa w 2007 i 2010 przez Andrade i Reissig. W swojej publikacji z 1963 roku Woodward zacytował Sir Roberta Robinsona, który powiedział, że ze względu na swój rozmiar cząsteczkowy jest to najbardziej złożona znana substancja .
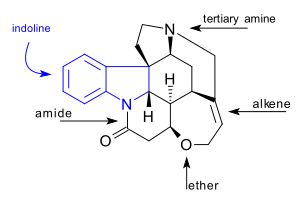
Cząsteczka
C 21 H 22 N 2 O 2 cząsteczka strychnina zawiera 7 pierścieni obejmujących sygnał indolinę systemu. Ma trzeciorzędową grupę aminową , amidową , alkenową i eterową . Naturalnie występujący związek jest również chiralny z 6 asymetrycznymi atomami węgla, w tym jednym czwartorzędowym.
Synteza Woodwarda
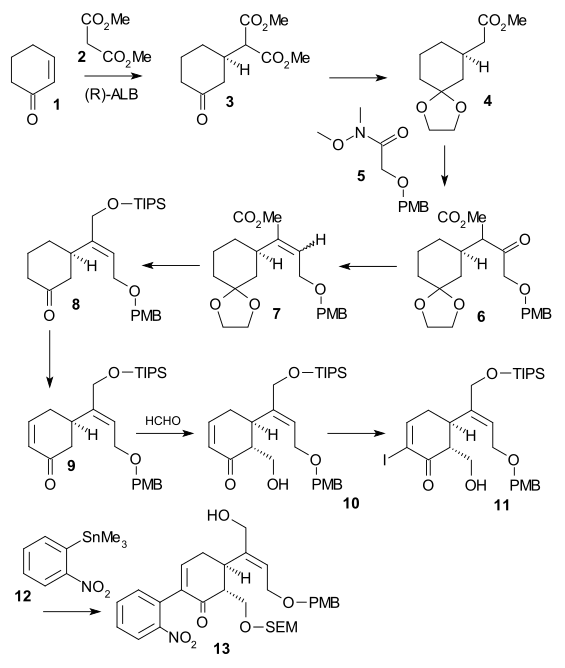
Pierścień II, synteza V
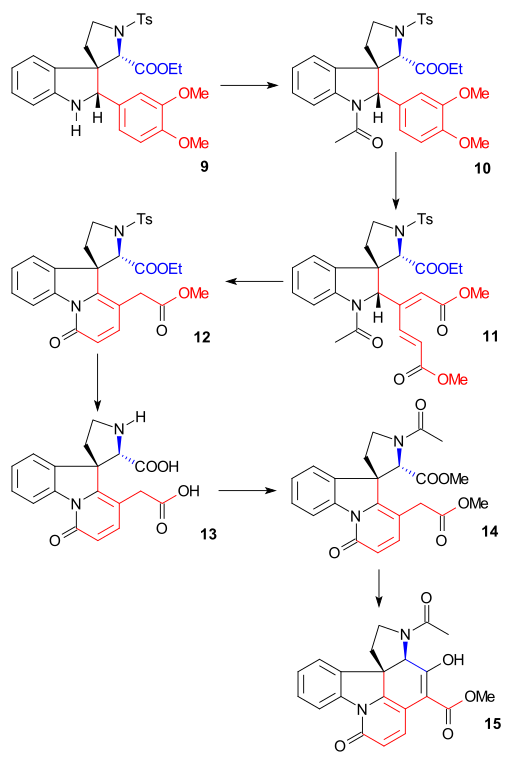
Syntezę pierścienia II przeprowadzono za pomocą syntezy indolu Fischera z użyciem fenylohydrazyny 1 i pochodnej acetofenonu acetoveratronu 2 (katalizatora kwasu polifosforowego ) z wytworzeniem 2-weratrylindolu 3 . Grupa veratrylowa nie tylko blokuje pozycję 2 dla dalszego podstawienia elektrofilowego, ale także stanie się częścią szkieletu strychniny. Reakcji Mannicha z formaldehydem i dwumetyloaminą ) wytwarzany graminy 4 . Alkilowanie z jodometanem otrzymano pośrednią czwartorzędową sól amonową , które poddaje się reakcji z cyjankiem sodu w reakcji podstawienia nukleofilowego z nitrylu 5 , a następnie w redukcji z wodorkiem litowo-glinowym do tryptaminy 6 . Amino-karbonylo kondensacji z glioksalan etylu Podać iminy 7 . Reakcja tej iminy z TsCl w pirydynie do związku N-tosylowego z zamkniętym pierścieniem 8 została opisana przez Woodwarda jako skoordynowany atak nukleofilowej enaminy i formalnie reakcja Picteta-Spenglera . Związek ten powinien tworzyć parę diastereomeryczną, ale znaleziono tylko jeden związek, chociaż którego nie badano. Ostatecznie nowo utworzone wiązanie podwójne zostało zredukowane przez borowodorek sodu do indoliny 9 z atomem wodoru C8 zbliżającym się od najmniejszej strony z zawadą przestrzenną (ten proton jest usuwany później w sekwencji i nie ma znaczenia).
Pierścień III, synteza IV,
Indoliny 9 był acetylowany na N-acetylo-związek 10 ( bezwodnik octowy , pirydyna ), a następnie grupa veratryl następnie otwarcia pierścienia z ozonem w Fazy wodne kwasu octowego do śluzowy estru 11 (możliwe przez dwie grupy metoksylanowe donorem elektronów). Jest to przykład bioinspired syntezy zostało już zaproponowane przez Woodward 1948 odszczepienie grupy acetylowej i hydrolizy estru z HCI w metanolu prowadziło do powstania pirydynowego estru 12 z dodatkowym izomeryzacji z egzocyklicznym wiązaniem podwójnym An endocyklicznego podwójnego wiązania (niszcząc jeden asymetryczny środek). W wyniku dalszego traktowania jodowodoru i czerwonego fosforu usunięto grupę tosylu i hydrolizowano obu pozostałych grup estrowych, z utworzeniem dikwas 13 . Acetylowanie i estryfikacja ( diazometan ) dały acetylodiester 14, który następnie poddano kondensacji Dieckmana z metanolanem sodu w metanolu do enolu 15 .
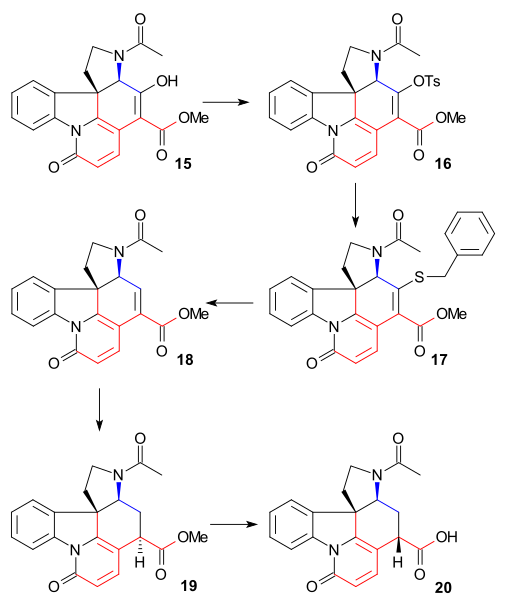
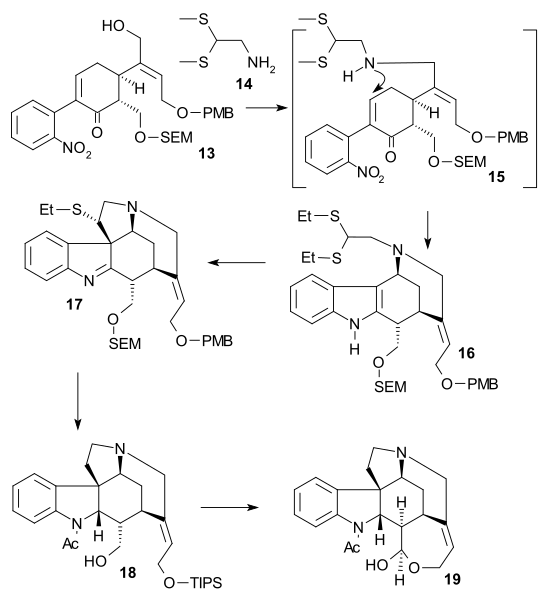
Synteza pierścienia VII
W celu usunięcia C15 alkoholu grupę enolowa 15 przekształcono tosylan 16 ( TsCl , pirydyna ), a następnie mercaptoester 17 (benzylmercaptide sodu), który następnie redukuje się do nienasyconego estru 18 przez nikiel Raney'a i wodór . Dalsza redukcja wodorem/ palladem na węglu dała nasycony ester 19 . Hydrolizie estrów alkalicznych do kwasu karboksylowego 20 towarzyszyła epimeryzacja przy C14.
Ten konkretny związek był już znany z badań degradacji strychniny. Do tej pory wszystkie związki pośrednie były racemiczne, ale chiralność została wprowadzona na tym konkretnym etapie poprzez chiralne rozdzielanie z użyciem chinidyny .
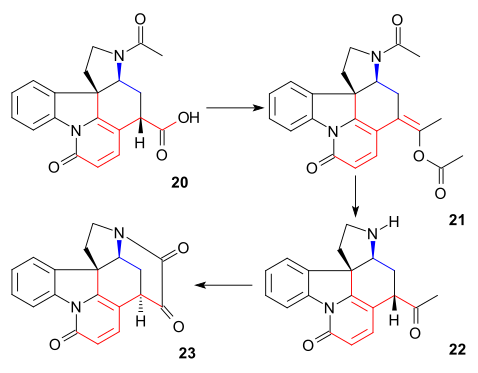
Atom węgla C20 wprowadzono następnie bezwodnikiem octowym z wytworzeniem octanu enolu 21 i wolny aminoketon 22 otrzymano przez hydrolizę kwasem chlorowodorowym . Pierścień VII w związku pośrednim 23 został zamknięty przez utlenianie ditlenku selenu , procesowi, któremu towarzyszyła ponownie epimeryzacja przy C14.
Tworzenie 21 można sobie wyobrazić jako sekwencję acylacji, deprotonacji, przegrupowania z utratą dwutlenku węgla i ponownie acylacji:
Synteza pierścienia VI
Do diketonu 23 dodano acetylenek sodu (wprowadzający atomy węgla 22 i 23), otrzymując alkin 24 . Związek ten zredukowano do alkoholu allilowego 25 przy użyciu katalizatora Lindlara, a wodorek litowo-glinowy w 26 usunął pozostałą grupę ketonową . Allilowy przegrupowanie alkoholu 27 (isostrychnine) została spowodowana przez bromowodorem w kwasie octowym, a następnie przez hydrolizę kwasem siarkowym . W końcowym etapie (-)-strychniny 28 traktowanie 27 etanolowym roztworem wodorotlenku potasu spowodowało przegrupowanie podwójnego wiązania C12-13 i zamknięcie pierścienia w addycji koniugatu przez anion hydroksylowy.
Synteza Magnusa
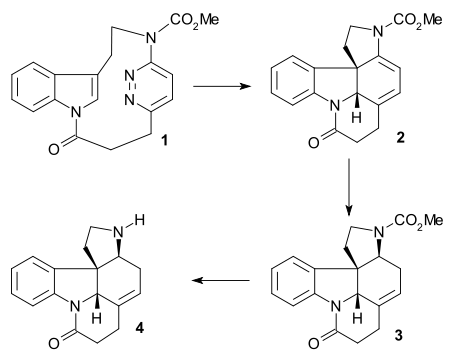
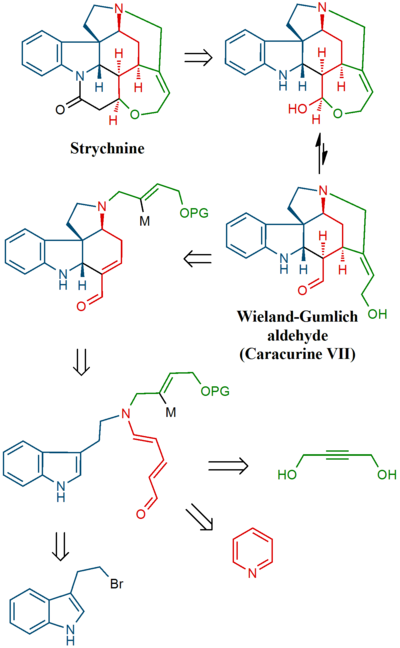
W tym wysiłku najpierw zsyntetyzowano jeden z wielu produktów degradacji strychniny (związek przekaźnikowy), związek dostępny również w kilku etapach z innego produktu degradacji, zwanego aldehydem Wielanda-Gumlicha . W ostatnim etapie sama strychnina została zsyntetyzowana ze związku przekaźnikowego.
Synteza Overmana
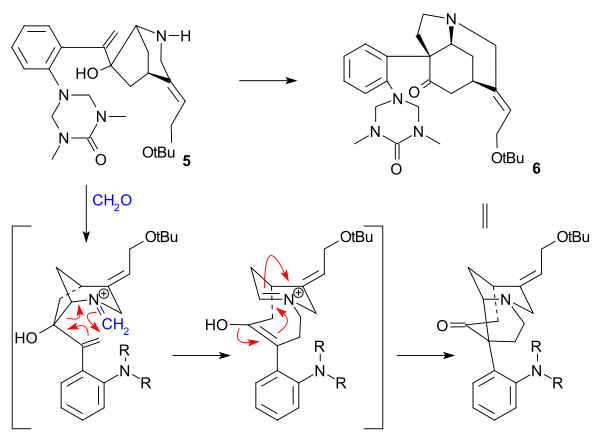
Overman syntezy (1993) miała chiralnej cyklopentenu związek jako produkt otrzymany w wyniku enzymatycznej rozpoczęciem hydrolizy z cis -1,4-diacetoxycyclopent-2-en. Ten materiał wyjściowy przekształcono w kilku etapach w trialkilostannan 2, który następnie sprzęgano z jodkiem arylu 1 w reakcji Stille'a w obecności tlenku węgla ( tris(dibenzylidenoacetono)dipallad(0) , trifenyloarsyna ). Wewnętrzna dwukrotnie w 3 przekształca się w epoksyd z użyciem tert-butylu The karbonylową grupa następnie przekształcić do alkenu w reakcji Wittiga , stosując Ph 3 P = CH 2 , a TIPS grupy hydrolizie ( TBAF ) i zastąpić trifluoroacetamid grupy (NH 2 COCF 3 , NaH ) w 4 . Cyklizacja (NaH) odbyła następnie otwarcie pierścienia epoksydowego i grupę trifluoroacetylową usuwa się za pomocą KOH, dające azabicyklooktanu 5 .
Kluczowym etapem była reakcja aza- Cope Mannicha zainicjowana kondensacją aminowo-karbonylową z użyciem formaldehydu i utworzeniem 6 z wydajnością ilościową:
W końcowej sekwencji strychninę uzyskano poprzez aldehyd Wielanda-Gumlicha ( 10 ):
Związek pośredni 6 acylowano przy użyciu cyjanomrówczanu metylu i dwie grupy zabezpieczające ( tert-butyl i ) usunięto przy użyciu HCl / MeOH w 7 . Podwójne wiązanie C8C13 zredukowano cynkiem (MeOH/H + ) do nasyconego estru 8 (mieszanina). Epimeryzacji na C13 z metanolanem sodu w metanolu wytwarza beta-estru 9 , które redukowano [[diizobutyloglinu]] do Wieland Gumlich aldehydu 10 . Konwersja tego związku z kwasem malonowym do (-)-strychniny 11 była już znana jako procedura.
Synteza Kuehne
Synteza Keuhne'a z 1993 roku dotyczy racemicznej strychniny. Związki wyjściowe tryptaminy 1 i 4,4-dimetoksy akroleinę 2 poddano reakcji z trifluorku boru z acetalu 3 w postaci pojedynczego diastereoizomeru w aminy karbonylo kondensacji / sigmatropic rearanżacja sekwencji.
Hydroliza z kwasu nadchlorowego otrzymano aldehyd 4 . Reakcji Johnson Coreya-Chaykovsky ( trimetylosulfoniowy jodek / n-butylolit ) w przeliczeniu na aldehyd z epoksydem , który poddaje się reakcji in situ z aminy trzeciorzędowej soli amoniowej 5 (zanieczyszczonego innymi cyklizacja). Redukcja ( pallad na węglu / wodór ) usunęła grupę benzylową do alkoholu 6 , dalsza redukcja ( cyjanoborowodorek sodu ) i acylacja ( bezwodnik octowy / pirydyna ) dała 7 jako mieszaninę epimerów (w C17). Zamknięcie pierścienia pierścienia III do 8 przeprowadzono następnie za pomocą reakcji aldolowej z użyciem bis(trimetylosililo)amidu litu (przy użyciu tylko epimeru o prawidłowej konfiguracji). Jeszcze bardziej zmniejszenie ( borowodorek sodu ) i acylowanie w wyniku epimerów di-octanu 9 .
DBU pośredniczy reakcję eliminacji tworzy olefinowego alkoholu 10 i następnie utlenianie Swerna mają niestabilne aminową ketonu 11 . W końcowych etapach reakcja Hornera-Wadswortha-Emmonsa ( 2-(dietylofosfono)octan metylu ) daje ester akrylanowy 12 jako mieszaninę izomerów cis i trans, które mogą być kierowane w prawo (trans) kierunku przez zastosowanie światła w fotochemicznym przegrupowanie , grupa estrowa została zredukowana ( DIBAL / trifluorek boru ) do izostrychniny 13, a racemiczna strychnina 14 została utworzona przez katalizowane zasadą zamknięcie pierścienia, jak w syntezie Woodwarda.
W 1998 Keuhne syntezy chiralnej (-)-strychniny materiał wyjściowy pochodził z chiralnego tryptofanu .
Synteza Rawala
W syntezie Rawala (1994, racemiczna) aminę 1 i enon 2 połączono w kondensacji aminowo-karbonylowej, a następnie zgaszono chloromrówczanem metylu do trienu 3, który następnie poddano reakcji w reakcji Dielsa-Aldera (benzen 185°C) do heksenu 4 . Trzy grupy estrowe hydrolizowano przy użyciu jodotrimetylosilanu tworząc pentacykliczny laktam 5 po schłodzeniu metanolem w kombinacji 7 etapów reakcji (jeden z nich to kondensacja Dieckmanna ). C 4 odcinek 6 dodano w alkilowania aminy i reakcja Heck'a z 7 tworzą isostrychnine 8 po odbezpieczenia TBS.
Całkowita wydajność (10%) jest jak dotąd największa ze wszystkich opublikowanych metod
Synteza Bosch
W syntezie Boscha (1999, chiralna) grupa olefinowa w dionie 1 została przekształcona w aldehyd przez ozonolizę, a chiralna amina 2 została utworzona w podwójnym redukcyjnym aminowaniu z ( S )-1- fenetyloaminą . Fenyloetylo podstawnik usunięto za ClCO 2 CHClCH 3 i enon grupę wprowadzono do eliminacji Grieco pomocą TMSI , HMDS następnie PhSeCl następnie ozonu , a następnie diizopropyloaminę tworzące karbaminian 3 . Grupę aminową odbezpiecza się przez ogrzewanie w temperaturze wrzenia w metanolu, a następnie alkilowane stosując ( Z ) -BrCH 2 Cich = CH 2 OTBDMS, do trzeciorzędowej aminy 4 . Redukcyjnym reakcję Hecka odbyła obok następnie methoxycarbonylation (LiHMDS NCCO 2 Me) do roweru trójkołowego 5 . Reakcja z pyłem cynkowym w 10% kwasie siarkowym usunęła grupę ochronną TBDMS , zredukowała grupę nitrową i spowodowała redukcyjną cyklizację aminokarbonylu w jednym etapie do tetracyklicznej 6 (mieszanina epimeryczna). W ostatnim etapie do Wieland Gumlich aldehyd 7 w reakcji z NaH w metanolu otrzymuje się prawidłowy epimeru została następnie DIBAH redukcję estru metylowego.
Synteza Vollhardta
Klucz reakcją syntezy Vollhardt (2000 racemiczny) był trimeryzacji alkinu z tryptaminy pochodną 1 z acetylenu i organocobalt związek CpCo (C 2 H 4 ) 2 (THF, 0 ° C) trójkołowego 2, po odbezpieczeniu grupy aminowej ( KOH, MeOH / H 2 O refluks). Późniejsza reakcja z azotanem żelaza spowodowała dodanie [1,8] -koniugatu do tetracyklu 3 , alkilowanie aminy za pomocą ( Z )-1-bromo-4-[(tert-butylodimetylosililo)oksy]-2-jodobut-2-enu ( patrz synteza Rawala ) i węglanu litu , a izomeryzacja układu dienowego (NaOiPr, iPrOH) utworzyła enon 4 . Reakcji Hecka , jak w Rawal Synthesis ( octan palladu / trifenylofosfino ), przy aromatyzacji utworzone pirydonu 5 i wodorku litowo-glinowego redukcji i odbezpieczenia grupy TBS utworzonej isostrychnine 6 .
Synteza Mori
Synteza Moriego ((-) chiralna, 2003) była pierwszą zawierającą asymetryczny etap reakcji . Zawiera również dużą liczbę reakcji katalizowanych przez Pd. W nim N-tosyloamina 1 reagowała z węglanem allilu 2 w allilowym asymetrycznym podstawieniu przy użyciu Pd 2 (dba) 3 i asymetrycznego liganda (S-BINAPO) do chiralnej drugorzędowej aminy 3 . Destylację z TBDMS następnej grupy miało miejsce przez HCl do wodorotlenku , a następnie w nitryl 4 ( NaCN ) przez bromek ( PBR 3 ). Reakcja Hecka ( Pd (OAc) 2 / Me 2 PPh ) i odbromowanie ( Ag 2 CO 3 ) otrzymano trójkołowego 5 . LiAlH 4 Redukcję nitrylu z aminy i jego Boc 2 O ochrony Do Boc aminę 6 następnie następuje drugi allilowego utleniania ( Pd (OAc) 2 / AcOH / benzochinon / MnO 2 ) do tetracycle 7 . Hydroborowanie-utlenianie ( 9-BBN / H 2 O 2 ) dało alkohol 8 i późniejsze utlenianie Swerna ketonu 9 . Reakcja z LDA / PhNTf 2 otrzymano trifluorometanosulfonian enolu 10 i grupa trifluorometanosulfonianowa usunięto alkenu 11 przez reakcję z Pd (OAc) 2 i PPh 3 .
Detosylation od 11 ( naphthalenide sodu ) i amidowania z chlorkiem kwasowym chlorek 3-bromoakryloilo dało amid 12 , a drugi reakcję Hecka dała pentacycle 13 . izomeryzacja podwójnego wiązania ( sodu / iPrOH ), Boc odbezpieczenie ( kwas trifluorometanosulfonowy ) i aminy alkilowania z (Z) -BrCH 2 Cich = CH 2 OTBDMS (patrz Rawal) dało związek 14 (identyczny z jednym ze związków pośrednich Vollhardt). Ostateczna reakcja Hecka ( 15 ) i TBDMS odbezpieczenie utworzona (-) - isostrychnine 16 .
Synteza Shibasaki
Synteza Shibasaki ((-) chiralna, 2002) była drugą opublikowaną metodą całkowitej syntezy strychniny przy użyciu etapu reakcji asymetrycznej . Cykloheksenon 1 poddano reakcji z malonianem dimetylu 2 w asymetrycznej reakcji Michaela z zastosowaniem AlLibis(binaftoksydu) z wytworzeniem chiralnego diestru 3 . Jego ketonową grupę zabezpieczony jako acetal (2-etylo-2-metylo-1,3-dioksolan, TsOH ) i grupę karboksylową usuwa się ( LiCl , DMSO 140 ° C) w monoester 4 . Fragment C2 dodano jako amid Weinreba 5 z wytworzeniem PMB eter 6 przy użyciu LDA . Keton następnie redukuje się do alkoholu ( NaBH 3 CN , TiCU 4 ), a następnie wodę wyeliminowane ( DCC , CuCI ) z wytworzeniem alkenu 7 . Po estru rozdrabniające ( DIBAL ) do alkoholu i jego TIPS ochrony ( TIPSOTf , trietyloamina ) grupę acetalową usunięto (katalityczny CSA ) w ketonie 8 . Enone 9 powstał następnie w wyniku utleniania Saegusa . Konwersja alkoholu 10 przeprowadzono przez dodanie aldolowej Mukaiyama pomocą formaldehydu , iodonation do 11 ( jodu , DMAP ) stosowano przez Stille łączącego ( Pd 2 dba 3 , Ph 3 Jako , Cul ) zawierające nitrobenzenu urządzenia 12 . Alkohol 13 powstał po zabezpieczeniu SEM (SEMCl,i-Pr2NEt) i usunięciu TIPS ( HF ).
W drugiej części sekwencji alkohol 13 został przekształcony w trifluorometanosulfonian ( bezwodnik triflinowy , N , N- diizopropyloetyloamina ), następnie dodano 2,2-bis(etylotio)etyloaminę 14, a następnie proszek cynkowy , co spowodowało reakcję tandemową z redukcja grupy nitrowej do aminy, 1,4-addycyjnej z grupy i tio-aminy amino-keto kondensacji do indol 16 . Reakcja z DMTSF dała thionium atak na C7 formowania 17 The iminową grupę wtedy zmniejszona ( NaBH 3 CN , TiCl 4 ), nową grupę aminową acyluje ( bezwodnik octowy , pirydyna ), zarówno alkohol grupy zabezpieczające usuwa się ( NaOMe / MeOH), a z grupa alkoholu allilowego ponownie zabezpieczona (TIPS). Pozwoliło to na usunięcie etylotio ( NiCl 2 , NaBH 4 , EtOH / MeOH) 18 . Alkohol utleniono do aldehydu stosując utlenianie Parikha-Doeringa i usunięcie grupy TIPS dało hemiacetal 19 zwany (+)-diaboliną, który jest acylowanym aldehydem Wielanda-Gumlicha .
Synteza Li
Synteza opisana przez Bodwell/Li (racemic, 2002) była syntezą formalną, ponieważ wytworzyła związek już przygotowany przez Rawala (nr 5 w syntezie Rawala). Kluczowym etapem była odwrotna zapotrzebowanie elektronów Dielsa-Aldera z cyklofanu 1 przez ogrzewanie w N , N -diethylaniline (diazotu jest expulsed), a następnie na drodze redukcji podwójnego wiązania w 2 do 3 za pomocą borowodorku sodu / kwasu trifluorometanosulfonowego i usunięciu karbaminianu ochrony grupa ( PDC / celite ) do 4 .
Metoda ta jest kwestionowana przez Reissig (patrz synteza Reissig).
Synteza Fukuyamy
Synteza Fukuyamy (chiralna (-), 2004) rozpoczęła się od cyklicznej aminy 1 . W pewnym momencie do tego materiału wyjściowego wprowadzono chiralność przez rozdział enzymatyczny jednego z prekursorów. Acyloina 2 została utworzona przez utlenianie i hydrolizę Ruottoma . Rozszczepienie utleniające przez octan ołowiu tworzy aldehyd 3 , usunięcie grupy nozylowej ( tiofenol / węglan cezu ) wywołało kondensację aminowo-karbonylową z jonem iminowym 4 kontynuującym reakcję w cyklizacji transpierścieniowej do diestru 5 , który można przekształcić w aldehyd Wielanda-Gumlicha przez znaną chemię.
Synteza Reisiga
Metoda opisana przez Beemelmannsa i Reissiga (racemic, 2010) jest kolejną formalną syntezą prowadzącą do pentacyklu Rawala (patrz amina 5 w metodzie Rawala). W tej metodzie indol 1 przekształcono w tetracykl 2 (wraz z produktem ubocznym) w pojedynczej kaskadowej reakcji z użyciem dijodku samaru i HMPA . Nikiel Raney'a / H 2 redukcja dała aminę 3 i reakcji w jednym naczyniu z zastosowaniem chloromrówczanu metylu , DMAP i TEA następnie MsCl , DMAP i TEA , a następnie DBU dała Rawal prekursora 4 z kluczowych atomów wodoru w pożądanej konfiguracji anty.
W przerwanej drodze półprodukt 2 został najpierw zredukowany do iminy 5, następnie przekształcony w karbaminian 6 , następnie odwodniony do dienu 7 ( odczynnik Burgessa ) i ostatecznie zredukowany do 8 ( cyjanoborowodorek sodu ). Atomy wodoru w 8 są w niepożądanym stosunku cis, co jest sprzeczne z wynikami uzyskanymi w 2002 roku przez Bodwell/Li dla tej samej reakcji.
Synteza Vanderwala
W 2011 roku grupa Vanderwal zgłosiła zwięzłą, najdłuższą liniową sekwencję 6 kroków, całkowitą syntezę strychniny. Zawierał reakcję Zincke, a następnie anionową reakcję bicyklizacji i tandemowe przegrupowanie Brooka / dodanie koniugatu .