Diazometan - Diazomethane
|
|
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Diazometan
|
|
| Inne nazwy
Azimetylen,
Azometylen, Diazyryna |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.005.803 |
| Numer WE | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| CH 2 N 2 | |
| Masa cząsteczkowa | 42,04 g/mol |
| Wygląd zewnętrzny | Żółty gaz |
| Zapach | stęchły |
| Gęstość | 1,4 (powietrze=1) |
| Temperatura topnienia | -145 ° C (-229 ° F; 128 K) |
| Temperatura wrzenia | -23°C (-9°F; 250 K) |
| hydroliza | |
| Struktura | |
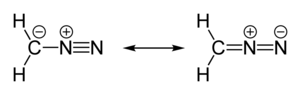
| liniowy C=N=N | |
| polarny | |
| Zagrożenia | |
| Główne zagrożenia | toksyczny i wybuchowy |
| Piktogramy GHS |
 
|
| Hasło ostrzegawcze GHS | Zagrożenie |
| H350 | |
| P201 , P202 , P281 , P308 + 313 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Dawka lub stężenie śmiertelne (LD, LC): | |
|
LC 50 ( mediana stężenia )
|
175 ppm (kot, 10 min) |
| NIOSH (limity ekspozycji dla zdrowia w USA): | |
|
PEL (dopuszczalne)
|
TWA 0,2 ppm (0,4 mg/m 3 ) |
|
REL (zalecane)
|
TWA 0,2 ppm (0,4 mg/m 3 ) |
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
2 ppm |
| Związki pokrewne | |
|
Powiązane grupy funkcyjne ;
związki |
RN=N=N ( azydek ), RN=NR (azowy); R 2 CN 2 R = Ph, tms, CF 3 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Diazometan to związek chemiczny CH 2 N 2 , odkryty przez niemieckiego chemika Hansa von Pechmanna w 1894 roku. Jest to najprostszy związek diazowy . W czystej postaci w temperaturze pokojowej jest niezwykle wrażliwym wybuchowym żółtym gazem ; w związku z tym jest prawie powszechnie stosowany jako roztwór w eterze dietylowym . Związek ten jest popularnym środkiem metylującym w laboratorium, ale jest zbyt niebezpieczny, aby stosować go na skalę przemysłową bez specjalnych środków ostrożności. Zastosowanie diazometanu zostało znacznie zredukowane dzięki wprowadzeniu bezpieczniejszego i równoważnego odczynnika trimetylosililodiazometanu .
Posługiwać się
Dla bezpieczeństwa i wygody diazometan jest zawsze przygotowywany w razie potrzeby jako roztwór w eterze i stosowany jako taki. Przekształca kwasy karboksylowe w estry metylowe i fenole w ich etery metylowe . Uważa się, że reakcja przebiega przez przeniesienie protonu z kwasu karboksylowego do diazometanu, z wytworzeniem kationu metylodiazoniowego, który reaguje z jonem karboksylanowym, dając ester metylowy i gazowy azot. Badania znakowania wskazują, że początkowy transfer protonu jest szybszy niż etap transferu metylu. Od przeniesienia protonu jest wymagana dla zajścia reakcji, reakcja ta jest selektywny dla bardziej kwasowe kwasów karboksylowych (P K ~ 5), fenolowe (s K ~ 10) nad alkoholi alifatycznych (s K ~ 15).
W bardziej wyspecjalizowanych zastosowaniach diazometan i homologi są wykorzystywane w syntezie Arndta-Eisterta i reakcji Büchnera-Curtiusa-Schlotterbecka do homologacji.
Diazometan reaguje z alkoholami lub fenolami w obecności trifluorku boru (BF 3 ) dając etery metylowe .
Jako źródło karbenu często stosuje się również diazometan . Z łatwością bierze udział w 1,3-dipolarnych cykloaddycjach .
Przygotowanie
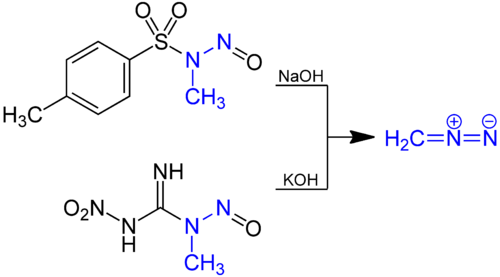
Diazometan wytwarza się przez hydrolizę eterowego roztworu N -metylonitrozoamidu z wodną zasadą. Prekursor tradycyjny jest N -nitroso- N metylomocznik , ale związek ten sam nieco niestabilny, a obecnie takie związki, jak N -metylo- N” -nitro- N -nitrosoguanidine (MNNG) i ń -metylo- N -nitroso- str -toluenesulfonamide (diazaldu) są korzystne.
CH 2 N 2 reaguje z zasadowymi roztworami D 2 O dając deuterowaną pochodną CD 2 N 2 .
Stężenie CH 2, N 2 może zostać określona w jednej z dwóch dogodnych sposobów. Można go traktować nadmiarem kwasu benzoesowego w zimnej Et 2 O. Nieprzereagowany kwas benzoesowy następnie miareczkowano standardowym NaOH. Alternatywnie, stężenie CO 2, N 2 w eterze 2 O może być określona metodą spektrofotometryczną przy 410 nm, przy czym jej współczynnik ekstynkcji , ε, wynosi 7.2. Stężenie diazometanu w fazie gazowej można określić za pomocą spektroskopii fotoakustycznej .
Związki pokrewne
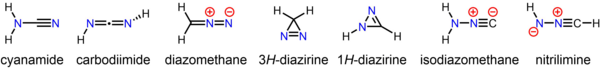
Diazometan jest zarówno izomeryczny, jak i izoelektroniczny z bardziej stabilnym cyjanamidem , ale nie mogą ulegać wzajemnemu przekształcaniu. Wytworzono wiele podstawionych pochodnych diazometanu:
- Bardzo stabilny (CF 3 ) 2 CN 2 (2-diazo-1,1,1,3,3,3-heksafluoropropan; temperatura wrzenia 12–13 °C),
- Ph 2 CN 2 ( diazodiphenylmethane o temperaturze topnienia 29-30 ° C).
- (CH 3 ) 3 SiCHN 2 ( trimetylosililodiazometan ), który jest dostępny w handlu w postaci roztworu, lecz jest równie skuteczny jak CH 2, N 2 dla metylacji.
- PhC(H)N 2 , czerwona ciecz o temperaturze wrzenia < 25°C przy 0,1 mm Hg.
Bezpieczeństwo
Diazometan jest toksyczny w przypadku wdychania lub kontaktu ze skórą lub oczami (TLV 0,2 ppm). Objawy obejmują dyskomfort w klatce piersiowej, ból głowy, osłabienie, aw ciężkich przypadkach zapaść. Objawy mogą być opóźnione. Zgłoszono zgony z powodu zatrucia diazometanem. W jednym przypadku pracownik laboratorium zjadł hamburgera w pobliżu wyciągu, w którym wytwarzał dużą ilość diazometanu, i zmarł cztery dni później z powodu piorunującego zapalenia płuc. Jak każdy inny środek alkilujący, oczekuje się, że jest rakotwórczy, ale obawy te są przyćmione przez jego poważną toksyczność ostrą.
CH 2 N 2 może eksplodować w kontakcie z ostrymi krawędziami, takimi jak połączenia szlifowanego szkła, a nawet zarysowania szkła. Naczynia szklane należy sprawdzić przed użyciem, a przygotowanie powinno odbywać się za osłoną przeciwwybuchową. W handlu dostępne są specjalistyczne zestawy do przygotowania diazometanu ze spoinami polerowanymi płomieniowo.
Związek eksploduje po podgrzaniu powyżej 100 °C, wystawiony na działanie intensywnego światła, metali alkalicznych lub siarczanu wapnia. Podczas używania tego związku wysoce zalecane jest użycie tarczy przeciwwybuchowej.
Dowód na koncepcję, praca została wykonana z Microfluidics , w której ciągła synteza punktem użytkowania z N -metylo- N -nitrosourea 0,93 M roztworu wodorotlenku potasu w wodzie, a następnie z punktu użyciu konwersji z kwasu benzoesowego , w wyniku czego z wydajnością 65% estru benzoesanu metylu w ciągu kilku sekund w temperaturach w zakresie od 0 do 50°C. Wydajność była lepsza niż w warunkach kapilarnych; mikroprzepływom przypisuje się „tłumienie gorących punktów, niskie zatrzymanie, warunki izotermiczne i intensywne mieszanie”.
Izomery
Stabilny związek cyjanamid , którego drugorzędnym tautomerem jest karbodiimid , jest izomerem diazometanu. Mniej stabilne, ale wciąż dające się oddzielić izomery diazometanu obejmują cykliczne 3 H -diazirine i isocyanoamine ( isodiazomethane ). Ponadto w warunkach izolacji matrycy zaobserwowano macierzystą nitryliminę .
Bibliografia
Zewnętrzne linki
- MSDS diazometan
- CDC — Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych
- Biuletyn techniczny Sigmaaldrich (PDF)
- Zastosowania diazometanu Sigma-Aldrich i dostępność komercyjna prekursora (Diazald)
- Reakcja Buchnera-Curtiusa-Schlotterbecka @ Institute of Chemistry, Skopje, Macedonia
- Identyfikacja artefaktów (produktów ubocznych) w reakcjach diazometanu i trimetylosililodiazometanu