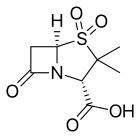
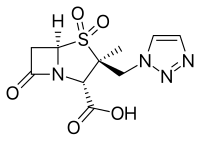
Inhibitor β-laktamazy - β-Lactamase inhibitor
Beta-laktamazy to rodzina enzymów biorących udział w oporności bakterii na antybiotyki beta-laktamowe . Działają poprzez rozerwanie pierścienia beta-laktamowego , który umożliwia działanie antybiotyków podobnych do penicyliny . Strategie zwalczania tej formy oporności obejmowały opracowanie nowych antybiotyków beta-laktamowych, które są bardziej odporne na rozszczepienie oraz opracowanie klasy inhibitorów enzymów zwanych inhibitorami beta-laktamazy . Chociaż inhibitory β-laktamaz same w sobie mają niewielką aktywność antybiotyczną, zapobiegają rozkładowi antybiotyków beta-laktamowych przez bakterie, a tym samym poszerzają zakres bakterii, przeciwko którym leki są skuteczne.
Zastosowania medyczne
Najważniejszym zastosowaniem inhibitorów beta-laktamaz jest leczenie zakażeń, o których wiadomo lub przypuszcza się, że są wywoływane przez bakterie Gram-ujemne , ponieważ wytwarzanie beta-laktamaz jest ważnym czynnikiem przyczyniającym się do oporności na beta-laktamy u tych patogenów. W przeciwieństwie do tego, większość oporności na beta-laktamy u bakterii Gram-dodatnich wynika z różnic w białkach wiążących penicylinę, które prowadzą do zmniejszonego wiązania z beta-laktamem. Gram-dodatni patogen Staphylococcus aureus wytwarza beta-laktamazy, ale inhibitory beta-laktamaz odgrywają mniejszą rolę w leczeniu tych infekcji, ponieważ najbardziej oporne szczepy ( staphylococcus aureus oporny na metycylinę ) również wykorzystują warianty białek wiążących penicylinę.
Mechanizm akcji
System klasyfikacji Amblera grupuje znane enzymy beta-laktamazy w cztery grupy zgodnie z homologią sekwencji i przypuszczalnymi zależnościami filogenetycznymi. Klasy A, C i D rozszczepiają beta-laktamy w wieloetapowym mechanizmie analogicznym do mechanizmu proteaz serynowych . Po związaniu serynowa grupa hydroksylowa w miejscu aktywnym beta-laktamazy tworzy przejściowe wiązanie kowalencyjne z grupą karbonylową pierścienia beta-laktamowego, rozszczepiając w tym procesie pierścień beta-laktamowy. W drugim etapie atak nukleofilowy przez cząsteczkę wody rozrywa wiązanie kowalencyjne między enzymem a grupą karbonylową niegdysiejszego beta-laktamu. Umożliwia to dyfuzję zdegradowanego beta-laktamu i uwalnia enzym do przetwarzania dodatkowych cząsteczek beta-laktamu.
Obecnie dostępne inhibitory beta-laktamaz są skuteczne przeciwko beta-laktamazom klasy A Amblera (tazobaktam, klawulanian i sulbaktam) lub przeciwko beta-laktamazom klasy Ambler klasy A, C i niektórym beta-laktamazom klasy D (awibaktam). Podobnie jak antybiotyki beta-laktamowe, są one przetwarzane przez beta-laktamazy do początkowego kowalencyjnego związku pośredniego. Inaczej niż w przypadku antybiotyków beta-laktamowych, inhibitory działają jako substraty samobójcze (tazobaktam i sulbaktam), co ostatecznie prowadzi do rozkładu beta-laktamazy. Z drugiej strony awibaktam nie zawiera pierścienia beta-laktamowego (inhibitor beta-laktamowy niebędący inhibitorem beta-laktamazy), a zamiast tego wiąże się w sposób odwracalny .
Beta- laktamazy klasy B Amblera rozszczepiają beta- laktamy w mechanizmie podobnym do metaloproteazy . Ponieważ nie tworzy się kowalencyjny związek pośredni, mechanizm działania dostępnych na rynku inhibitorów beta-laktamazy nie ma zastosowania. Tak więc rozprzestrzenianie się szczepów bakteryjnych eksprymujących metalo-beta-laktamazy, takich jak metalo-beta-laktamaza 1 z New Delhi, wywołało znaczne obawy.
Powszechnie stosowane środki
Obecnie sprzedawane inhibitory β-laktamazy nie są sprzedawane jako pojedyncze leki. Zamiast tego są formułowane razem z antybiotykiem β-laktamowym o podobnym okresie półtrwania w surowicy. Odbywa się to nie tylko dla wygody dawkowania, ale także w celu zminimalizowania rozwoju oporności, który może wystąpić w wyniku różnej ekspozycji na jeden lub drugi lek. Główne klasy antybiotyków β-laktamowych stosowanych w leczeniu zakażeń bakteriami Gram-ujemnymi obejmują (w przybliżonej kolejności wewnętrznej oporności na rozszczepienie przez β-laktamazy) penicyliny (zwłaszcza aminopenicyliny i ureidopenicyliny), cefalosporyny III generacji i karbapenemy. Poszczególne warianty β-laktamazy mogą być ukierunkowane na jedną lub wiele z tych klas leków, a tylko podzbiór będzie hamowany przez dany inhibitor β-laktamazy. Inhibitory β-laktamaz rozszerzają użyteczne spektrum tych antybiotyków β-laktamowych poprzez hamowanie enzymów β-laktamaz wytwarzanych przez bakterie w celu ich dezaktywacji.
- Inhibitory β-laktamaz z rdzeniem β-laktamowym:
- Tebipenem jest pierwszym podawanym doustnie karbapenemem w postaci tebipenemu-piwoksylu. Dostępne są badania strukturalne i kinetyczne tebipenemu z beta-laktamazą M. tuberculosis (BlaC).
- Kwas klawulanowy lub klawulanian, zwykle w połączeniu z amoksycyliną ( Augmentin ) lub tikarcyliną ( Timentin )
- Sulbaktam , zwykle łączony z ampicyliną ( Unasyn ) lub cefoperazonem ( Sulperazon )
- Tazobaktam , zwykle łączony z piperacyliną ( Zosyn i Tazocin )
- Inhibitory β-laktamaz z rdzeniem diazabicyklooktanowym :
- Awibaktam , zatwierdzony w skojarzeniu z ceftazydymem ( Avycaz ) , obecnie w trakcie badań klinicznych nad skojarzeniem z ceftaroliną
- Relebaktam , stosowany w połączeniu z imipenemem/cylastatyną ( Recarbrio ).
- Inhibitory β-laktamaz z innymi typami rdzeni nieβ-laktamowych:
- Vaborbaktam , stosowany w połączeniu z meropenemem ( Vabomere ). Posiada rdzeń z kwasu borowego .
Bakterie wytwarzające beta-laktamazę
Bakterie, które mogą wytwarzać beta-laktamazy obejmują między innymi:
-
Staphylococcus
- MRSA (gronkowiec złocisty oporny na metycylinę)
- Enterobacteriaceae :
- Haemophilus influenzae
- Neisseria gonorrhoeae
- Pseudomonas aeruginosa
- Prątek gruźlicy
Badania
Niektóre bakterie mogą wytwarzać β-laktamazy o rozszerzonym spektrum (ESBL), co utrudnia leczenie infekcji i nadaje dodatkową oporność na penicyliny , cefalosporyny i monobaktamy . Pochodne kwasu borowego są obecnie przedmiotem szeroko zakrojonych i szeroko zakrojonych badań jako nowe inhibitory miejsc aktywnych dla beta-laktamaz, ponieważ zawierają miejsce, które naśladuje stan przejściowy, przez który przechodzą beta-laktamy podczas hydrolizy przez beta-laktamazy. Stwierdzono, że ogólnie dobrze pasują do miejsca aktywnego wielu beta-laktamaz i mają dogodną właściwość niemożności hydrolizy, a zatem stają się bezużyteczne. Jest to korzystny projekt leku w porównaniu z wieloma klinicznie stosowanymi środkami konkurencyjnymi, ponieważ większość z nich, jak np. kwas klawulanowy, ulega hydrolizie i dlatego jest użyteczna tylko przez ograniczony okres czasu. Na ogół powoduje to potrzebę wyższego stężenia kompetycyjnego inhibitora niż byłoby to konieczne w przypadku niehydrolizowalnego inhibitora. Różne pochodne kwasu borowego mogą być dostosowywane do wielu różnych izoform beta-laktamaz, a zatem mogą przywracać siłę działania antybiotyków beta-laktamowych.
Bibliografia
Zewnętrzne linki
- Xu H, Hazra S, Blanchard JS (czerwiec 2012). „NXL104 nieodwracalnie hamuje β-laktamazę z Mycobacterium tuberculosis” . Biochemia . 51 (22): 4551-7. doi : 10.1021/bi300508r . PMC 3448018 . PMID 22587688 .
- Kurz SG, Wolff KA, Hazra S, Bethel CR, Hujer AM, Smith KM, Xu Y, Tremblay LW, Blanchard JS, Nguyen L, Bonomo RA (grudzień 2013). „Czy substytucje oporne na inhibitory w Mycobacterium tuberculosis β-laktamazy BlaC mogą prowadzić do oporności na klawulanian?: biochemiczne uzasadnienie stosowania kombinacji inhibitorów β-laktam-β-laktamazy” . Środki przeciwdrobnoustrojowe i chemioterapia . 57 (12): 6085–96. doi : 10.1128/AAC.01253-13 . PMC 3837893 . PMID 24060876 .