Awibaktam - Avibactam
 | |
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Avycaz (skomponowany z ceftazydymem) |
| Dane licencyjne | |
| Drogi administracji |
IV |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | 100% (dożylnie) |
| Wiązanie białek | 5,7-8,2% |
| Metabolizm | Zero |
| Początek akcji | Zwiększa się proporcjonalnie do dawki |
| Wydalanie | Nerki (97%) |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CZEBI | |
| CHEMBL | |
| Dane chemiczne i fizyczne | |
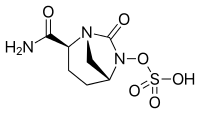
| Formuła | C 7 H 11 N 3 O 6 S |
| Masa cząsteczkowa | 265,24 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Awibaktam jest nieβ -laktamowym inhibitorem β-laktamaz opracowanym przez Actavis (obecnie Teva ) wspólnie z firmą AstraZeneca . Rejestrację nowego leku do avibactam w połączeniu z ceftazydymu (oznaczone jako Avycaz) został zatwierdzony przez FDA w dniu 25 lutego 2015 roku do leczenia skomplikowanych dróg moczowych (cuti) i skomplikowane w jamie brzusznej, zakażenia (cIAI) powodowanych przez oporne na antybiotyki-patogenów , w tym wywołane przez wielolekooporne bakterie Gram-ujemne .
Rosnąca oporność na cefalosporyny wśród bakteryjnych patogenów Gram-(−), zwłaszcza wśród zakażeń szpitalnych, wynika częściowo z produkcji enzymów β-laktamazowych, które dezaktywują te antybiotyki. O ile jednoczesne podawanie inhibitora β-laktamazy może przywrócić aktywność przeciwbakteryjną w cefalosporyny wcześniej zatwierdzony inhibitory β-laktamazy, takich jak tazobaktamu i kwas klawulanowy nie hamują ważnych klas beta-laktamazy, w tym Klebsiella pneumoniae karbapenemaz (KPCS), New Delhi metalo-β-laktamaza 1 (NDM-1) i β-laktamazy typu AmpC . Chociaż awibaktam hamuje β-laktamazy klasy A (KPC, CTX-M, TEM, SHV), klasy C (AmpC) i niektóre β-laktamazy serynowe klasy D (takie jak OXA-23, OXA-48), stwierdzono, że być słabym substratem/słabym inhibitorem metalo -β-laktamaz klasy B , takich jak VIM-2, VIM-4, SPM-1, BcII, NDM-1, Fez-1.
W przypadku zakażeń wywołanych przez bakterie wytwarzające metalo-β-laktamazy strategia terapeutyczna polega na podawaniu awibaktamu jako leku towarzyszącego podawanego razem z aztreonamem. W rzeczywistości, chociaż teoretycznie aztreonam nie jest hydrolizowany przez metalo-β-laktamazy, wiele szczepów wytwarzających metalo-β-laktamazy współprodukuje enzymy, które mogą hydrolizować aztreonam (np. AmpC, ESBL), dlatego podaje się awibaktam w celu ochrony aztreonamu, wykorzystując jego silne hamowanie β-laktamaz .
Zobacz też
Bibliografia
Zewnętrzne linki
-
T. Edeki; J. Armstronga; J. Li. „Farmakokinetyka awibaktamu (AVI) i ceftazydymu (CAZ) po podaniu oddzielnym lub skojarzonym u zdrowych ochotników” . Zarchiwizowane od oryginału 03.03.2016. Cytowanie dziennika wymaga
|journal=( pomoc )
