Nagroda za stymulację mózgu - Brain stimulation reward
Nagroda za stymulację mózgu ( BSR ) to przyjemne zjawisko wywoływane przez bezpośrednią stymulację określonych obszarów mózgu, pierwotnie odkryte przez Jamesa Oldsa i Petera Milnera . BSR może służyć jako silne wzmocnienie instrumentalne . Ukierunkowana stymulacja aktywuje obwody układu nagrody i ustanawia nawyki reagowania podobne do tych ustanowionych przez naturalne nagrody , takie jak jedzenie i seks. Eksperymenty na BSR wkrótce wykazały, że stymulacja bocznego podwzgórza , wraz z innymi obszarami mózgu związanymi z naturalną nagrodą, była zarówno satysfakcjonująca, jak i motywująca. Elektryczna stymulacja mózgu i wewnątrzczaszkowe wstrzyknięcia leków wywołują silne odczucie nagrody dzięki stosunkowo bezpośredniej aktywacji układu nagrody. Uważa się, że ta aktywacja jest bardziej bezpośrednia niż nagrody wytwarzane przez naturalne bodźce, ponieważ sygnały te zazwyczaj przechodzą przez bardziej pośrednie nerwy obwodowe . BSR wykryto u wszystkich badanych kręgowców, w tym u ludzi, i dostarczyło to użytecznego narzędzia do zrozumienia, w jaki sposób naturalne nagrody są przetwarzane przez określone regiony i obwody mózgu, a także neuroprzekaźnictwo związane z układem nagrody.
Samostymulacja wewnątrzczaszkowa ( ICSS ) jest metodą warunkowania instrumentalnego stosowaną do wytwarzania BSR w warunkach eksperymentalnych. ICSS zazwyczaj obejmuje osoby ze stałymi implantami elektrod w jednym z kilku obszarów mózgu, o których wiadomo, że podczas stymulacji wytwarzają BSR. Badani są szkoleni do ciągłego reagowania na stymulację elektryczną tego regionu mózgu. Badania ICSS były szczególnie przydatne do badania wpływu różnych manipulacji farmakologicznych na wrażliwość na nagrodę. ICSS został wykorzystany jako środek do oceny uzależnienia od leków wielu klas, w tym tych, które działają na neuroprzekaźnictwo monoaminergiczne, opioidowe i cholinergiczne. Dane te dobrze korelują z wynikami badań nad samodzielnym podawaniem uzależniających właściwości leków.
Historia
W 1953 roku James Olds i Peter Milner z McGill University zaobserwowali, że szczury wolą wracać do obszaru aparatury testowej, gdzie otrzymywały bezpośrednią stymulację elektryczną do przegrody mózgowej. Z tej demonstracji Olds i Milner wywnioskowali, że stymulacja była satysfakcjonująca, a poprzez kolejne eksperymenty potwierdzili, że mogą nauczyć szczury wykonywania nowych zachowań, takich jak naciskanie dźwigni, w celu otrzymywania krótkich impulsów stymulacji mózgu. Olds i Milner odkryli mechanizmy nagrody w mózgu zaangażowane w pozytywne wzmocnienie, a ich eksperymenty doprowadziły do wniosku, że stymulacja elektryczna może służyć jako wzmocnienie instrumentalne. Według BF Skinnera wzmocnienie instrumentalne występuje, gdy po zachowaniu następuje prezentacja bodźca i jest uważane za niezbędne do uczenia się nawyków reagowania. Ich odkrycie umożliwiło zrozumienie motywacji i wzmocnienia w kategoriach ich podstawowej fizjologii i doprowadziło do dalszych eksperymentów w celu określenia neuronalnej podstawy nagrody i wzmocnienia. Od czasu pierwszego odkrycia zjawisko BSR wykazano u wszystkich badanych gatunków, a Robert Heath podobnie wykazał, że BSR można zastosować u ludzi.
W jednym z często cytowanych przykładów, w 1972, obiekt Heatha znany jako „B-19” zgłaszał „uczucia przyjemności, czujności i ciepła” i „protestował za każdym razem, gdy odbierano mu urządzenie, błagając o samostymulację tylko kilku osób. więcej razy". Wśród etyków wczesne eksperymenty „bezpośredniej stymulacji mózgu” lub „psychochirurgii” były krytykowane jako „wątpliwe i niepewne (nawet) według wczorajszych standardów”. W przypadku opublikowanym w 1986 roku pacjentka, której dano zdolność do samostymulacji w domu, zignorowała swoją rodzinę i higienę osobistą i spędziła całe dni na autostymulacji elektrycznej. Zanim jej rodzina interweniowała, pacjentka rozwinęła otwartą ranę na palcu w wyniku wielokrotnego dostosowywania prądu.
Wzmocnienie stymulacji mózgu
Wczesne badania nad motywacyjnymi skutkami stymulacji mózgu dotyczyły dwóch podstawowych pytań: 1. Które obszary mózgu można stymulować, aby wytworzyć percepcję nagrody? oraz 2. Jakie leki wpływają na odpowiedź na stymulację i poprzez jaki mechanizm? Badanie obwodu nagrody w mózgu ujawnia, że składa się on z rozproszonego, wielosynaptycznego obwodu, który determinuje zarówno BSR, jak i naturalną funkcję nagrody. Naturalne popędy, które motywują i kształtują zachowanie, docierają do obwodów nagrody transsynaptycznie poprzez peryferyjne zmysły wzroku, dźwięku, smaku, zapachu lub dotyku. Jednak eksperymentalnie wywołany BSR bardziej bezpośrednio aktywuje układ nagrody i omija transdukcję przez obwodowe ścieżki czuciowe. Z tego powodu elektryczna stymulacja mózgu stanowi narzędzie do identyfikacji obwodów nagrody w ośrodkowym układzie nerwowym z pewnym stopniem swoistości anatomicznej i neurochemicznej. Badania, w których te dwie formy w laboratorium nagrodę wykazały stymulowanie szerokiego zakresu struktur limbicznych i jądrach podwzgórza mogą być satysfakcjonujące, jak również odgrywa rolę dopaminy Niezawierające neurony mesolimbicznej układu dopaminy w funkcji motywacji. Motywacyjny efekt samostymulacji wewnątrzczaszkowej różni się znacznie w zależności od miejsca umieszczenia chirurgicznie wszczepionej elektrody podczas stymulacji elektrycznej, a zwierzęta będą pracować nad stymulacją różnych miejsc nerwowych w zależności od ich aktualnego stanu. Często zwierzęta, które pracują nad zainicjowaniem stymulacji mózgu, będą również działać w celu zakończenia stymulacji.
Związek z naturalnymi nagrodami i popędami
Związek między BSR a naturalnymi nagrodami (np. jedzeniem, wodą i kopulacją) był od dawna przedmiotem dyskusji, a wiele wczesnych badań nad BSR koncentruje się na ich odpowiednich podobieństwach i różnicach. BSR jest ułatwiony dzięki tej samej ścieżce wzmocnienia aktywowanej przez naturalne nagrody. Samostymulacja może wywierać silną aktywację centralnych mechanizmów nagrody dzięki bardziej bezpośredniemu działaniu niż naturalne nagrody, które początkowo aktywują nerwy obwodowe . BSR do pęczka przyśrodkowego przodomózgowia (MFB) za pomocą środków elektrycznych lub chemicznych aktywuje kluczowe elementy ścieżki nagrody również aktywowane przez naturalne nagrody. Kiedy określone obszary podwzgórza są stymulowane elektrycznie, wywołuje to zachowania związane z nagrodą, takie jak jedzenie, picie lub reakcje kopulacyjne.
Nagrody naturalne wiążą się ze stanem pozbawienia niezaspokojonych potrzeb lub pragnień (np. głód). Stany te kierują instynktownymi, zmotywowanymi zachowaniami, takimi jak konsumpcja żywności. Argumentowano, że tak nie jest w przypadku BSR, ponieważ nie spełnia on wrodzonej potrzeby związanej z przetrwaniem. . W BSR w szczególności brakuje również ugruntowanej reprezentacji neuronowej w pamięci, która w naturalny sposób ułatwia uczenie się oczekiwania na nagrodę. Oba te efekty prowadzą do zmniejszonego wskaźnika odpowiedzi dla BSR we wczesnych próbach serii; jednak eksperymenty wykazały również, że wygaszone zachowanie można szybko przywrócić przez stymulację poprzedzającą, która odświeża krótkoterminowy związek związany z oczekiwaniem nagrody. Badania nad BSR wskazują, że wzmocnienie stymulacji mózgu może aktywować naturalne ścieżki związane z naturalnymi popędami, a także stymulować ścieżki wzmocnienia, które zwykle są aktywowane przez naturalne nagrody.
Siła popędu
Szczury będą wykonywać naciskanie dźwigni z szybkością kilku tysięcy odpowiedzi na godzinę przez kilka dni w zamian za bezpośrednią elektryczną stymulację bocznego podwzgórza . Wiele badań wykazało, że szczury będą wykonywać wzmocnione zachowania z wyłączeniem wszystkich innych zachowań. Eksperymenty wykazały, że szczury będą rezygnować z jedzenia aż do zagłodzenia w zamian za stymulację mózgu lub dożylną kokainę, gdy zarówno pożywienie, jak i stymulacja są oferowane jednocześnie przez ograniczony czas każdego dnia. Szczury przechodzą również przez sieci elektryczne, aby nacisnąć dźwignię i są gotowe wytrzymać wyższe poziomy wstrząsu, aby uzyskać stymulację elektryczną niż pożywienie.
Nasycenie
Eksperymenty nasycenia na szczurach wykazały, że BSR nie wywołuje sytości. Olds wykazał, że ten brak nasycenia związany z BSR umożliwia zwierzętom samostymulację do całkowitego wyczerpania, a nasycenie zależy od lokalizacji stymulacji elektrycznej. W 48-godzinnym teście nasycenia szczury z elektrodami podwzgórzowymi samostymulowały się do wyczerpania i nie wykazywały wewnętrznych tendencji do nasycenia, podczas gdy elektrody telemózgowia wykazywały radykalne spowolnienie samostymulacji po 4 do 8 godzinach. Nienasycenie BSR jest ściśle związane z siłą popędu. Podczas gdy naturalna nagroda, taka jak jedzenie, spotyka się z uczuciem sytości (sytości), BSR nie ma porównywalnego korelacji. Pozwala to na doświadczanie BSR w nieskończoność lub, w przypadku ICSS, do wyczerpania.
Uzależnienie
Uzależnienie to przewlekłe zaburzenie mózgu polegające na kompulsywnym przyjmowaniu i szukaniu narkotyków, które utrzymuje się pomimo szkodliwego wpływu na różne aspekty życia, w tym zdrowie, związki i pracę. Procedury laboratoryjne mogą wytworzyć kompulsywne nawyki samozarządzania polegające na szukaniu i przyjmowaniu, które kwalifikują się jako zachowania uzależniające. Wykazano, że gryzonie i naczelne niebędące ludźmi pracują w sposób kompulsywny, otrzymując dożylne zastrzyki stymulantów, a gdy dostęp do leków nie jest ograniczony, będą same podawać leki, aż do poważnej utraty wagi i śmierci. Podobnie jak w przypadku samodzielnego podawania, reagowanie na wewnątrzczaszkową stymulację mózgu ma wysoce kompulsywny komponent charakterystyczny dla stanu uzależnienia. Przypuszcza się, że BSR jest tak skuteczny w ustanawianiu kompulsywnych nawyków ze względu na bardziej bezpośrednią aktywację ścieżki nagrody, omijając transmisję przez ścieżki sensoryczne w odpowiedzi na naturalne nagrody. Opóźnione wzmocnienie po odpowiedzi na BSR zmniejsza, jak silnie to zachowanie jest wzmacniane i do jakiego stopnia jest kontynuowane. Na przykład jednosekundowe opóźnienie między naciśnięciem dźwigni a dostarczeniem nagrody (stymulacja) może zmniejszyć poziomy odpowiedzi. BSR oferuje wgląd w obwody neuronalne zaangażowane we wzmacnianie i zachowania kompulsywne.
Anatomia nagrody
Badania mapowania i uszkodzeń BSR zostały zaprojektowane w celu określenia lokalizacji neuronów związanych z nagrodą, a także określenia ścieżek sygnałowych, na które bezpośrednio wpływa stymulacja mózgu. Miejsce autostymulacji wewnątrzczaszkowej prowadzi do istotnie różnych cech behawioralnych. Miejsca wzdłuż długości pęczka przyśrodkowego przodomózgowia (MFB) przez boczny i tylny podwzgórze , brzuszny obszar nakrywkowy (VTA) i do mostu są związane z najsilniejszymi efektami nagrody stymulacji.
Boczny podwzgórze
Bocznego podwzgórza jest częścią podwzgórza i pobudzenie mózgu w tym obszarze na poziomie wiązki przyśrodkowego przodomózgowia tworzy najwyższy wskaźnik odpowiedzi, a następnie największą moc nagrody gryzoni. Uszkodzenia w tym regionie lub wzdłuż jego granicy powodują utratę pozytywnych zachowań popędu-nagrody, jak również wszystkich innych zachowań popędu operacyjnego.
Pakiet przyśrodkowego przodomózgowia
Przyśrodkowe przodomózgowie (MFB), to położenie z najczęściej badanych miejsc stymulacji mózgu nagrodę, i składa się ona z kompleksu wiązki aksonów wystających z podstawnych zapachowe regionów i przegrody jąder . MFB nie jest jedynym podłożem anatomicznym odpowiedzialnym za wzmocnienie stymulacji mózgu; jednakże jest to główny szlak dla wstępujących włókien dopaminowych i jego funkcją jest przekazywanie informacji z VTA do jądra półleżącego . Nagradzający efekt stymulacji MFB odbywa się poprzez aktywację mezokortykolimbicznego układu dopaminowego.
Szlak mezolimbiczny
Szlak mezolimbiczny łączy VTA z jądrem półleżącym . Jądro półleżące znajduje się w prążkowiu brzusznym i integruje informacje ze struktur korowych i limbicznych mózgu, aby pośredniczyć w zachowaniach wzmacniających nagrodę. Jest głównym celem projekcji dopaminergicznych z VTA, grupy neuronów zlokalizowanych blisko linii środkowej na dnie śródmózgowia . VTA jest źródłem ciał komórek dopaminergicznych , które tworzą mezokortykolimbiczny układ dopaminowy.
Wykazano, że BSR powoduje uwalnianie dopaminy w jądrze półleżącym, co występuje również w odpowiedzi na naturalne nagrody, takie jak jedzenie lub seks.
Aktywacja pośrednia
Dane elektrofizjologiczne sugerują, że stymulacja MFB lub VTA nie aktywuje bezpośrednio neuronów dopaminergicznych w mezolimbicznym szlaku nagrody. Dane te sugerują, że BSR jest ułatwione przez początkowe pobudzenie zstępujących, mielinizowanych neuronów, które następnie aktywują wstępujące, niezmielinizowane neurony VTA. Uważa się, że pobudzające, cholinergiczne sygnały wejściowe do VTA odgrywają rolę w tej pośredniej aktywacji, ale elementy neuroanatomiczne tego obwodu nie zostały jeszcze w pełni scharakteryzowane.
Zabiegi autostymulacji wewnątrzczaszkowej (ICSS))
Wstępny trening
Od czasu pierwszego zademonstrowania BSR przez Oldsa i Milnera, eksperymenty na gryzoniach rejestrują reakcję ICSS w celu ilościowego określenia motywacji do otrzymywania stymulacji. Badani przechodzą operację stereotaktyczną, aby na stałe wszczepić elektrodę monopolarną lub bipolarną do pożądanego obszaru mózgu. Elektrody są podłączone do aparatu stymulującego w czasie eksperymentu.
Pierwsza część eksperymentu ICSS obejmuje szkolenie podmiotów, aby odpowiadały na stymulację przy użyciu harmonogramu wzmocnienia o stałym współczynniku 1 (FR-1) (1 odpowiedź = 1 nagroda). W eksperymentach na szczurach, osobniki są szkolone, aby naciskać dźwignię w celu stymulacji, a szybkość naciskania dźwigni jest zwykle zmienną zależną . W badaniach ICSS na myszach zamiast dźwigni stosuje się zwykle koło odpowiedzi, ponieważ myszy nie wykonują konsekwentnie zachowań polegających na naciskaniu dźwigni. Każdy ćwierć obrotu koła odpowiedzi jest rejestrowany i nagradzany stymulacją. Bodźcem nagradzającym w eksperymentach BSR jest zazwyczaj ciąg krótkotrwałych impulsów oddzielonych impulsami interwałowymi, którymi można manipulować eksperymentalnie przy użyciu niezależnych zmiennych amplitudy stymulacji, częstotliwości i czasu trwania impulsu .
Ustalenie minimalnego prądu efektywnego
Amplituda (prąd) stymulacji określa populację neuronów aktywowanych przez wszczepioną elektrodę. W niektórych podejściach jest to dostosowywane dla każdego pacjenta ze względu na niewielką zmienność w rozmieszczeniu elektrod, a zatem nieco inną populację dotkniętych neuronów. Po szkoleniu FR1 typowe jest ustalenie minimalnego, progowego prądu, który powoduje wystarczający poziom odpowiedzi ICSS (około 40 odpowiedzi na minutę). Nazywa się to procedurą dyskretnego natężenia prądu. Każda dyskretna próba składa się z nieprzypadkowej stymulacji o określonej amplitudzie, po której następuje krótkie okno, podczas którego zwierzę może odpowiedzieć na większą stymulację. Prądy efektywne dla BSR wywołują odpowiedzi powyżej pewnego wskaźnika (na przykład 3 z 4 prób). Najniższy prąd, na który zwierzę reaguje wystarczająco, jest uważany za minimalny skuteczny prąd. Odbywa się to przy stałej częstotliwości, zazwyczaj na wyższym końcu zakresu częstotliwości stosowanego w badaniach ICSS (140–160 Hz).
Projekt badania wewnątrzobiektowego jest często wdrażany w celu wyeliminowania zmienności wprowadzanej przez umieszczenie elektrod. Projekt badania międzyobiektowego wymaga rygorystycznej weryfikacji histologicznej umiejscowienia elektrod w celu zapewnienia spójności między grupami eksperymentalnymi. Osoby z niedoskonałym umieszczeniem elektrod wymagają wyższej amplitudy symulacji, aby aktywować obwód nagrody i wytworzyć odpowiedź ICSS. Osoby o idealnym ułożeniu anatomicznym zareagują przy niższych amplitudach stymulacji. Ten proces naprawczy jest jednak ograniczony, ponieważ zwiększenie populacji aktywowanych neuronów może skutkować nieoczekiwaną aktywacją sąsiednich obwodów. Często kończy się to niepożądanymi motorycznymi skutkami ubocznymi po stymulacji, z powodu sąsiedztwa MFB z wewnętrzną torebką , wiązką aksonów niosących zstępującą informację motoryczną do pnia mózgu . Nieumyślna stymulacja tych aksonów może prowadzić do zdolności motorycznych, takich jak ruch głowy lub drganie łapy.
Odpowiadanie na częstotliwość
Przy stałym minimalnym efektywnym prądzie, odpowiedź ICSS jest rejestrowana w serii prób, które różnią się częstotliwością stymulacji. Każda próba składa się z krótkiej fazy inicjowania niewarunkowej stymulacji, fazy odpowiedzi, w której odpowiedzi są rejestrowane i nagradzane stymulacją, oraz fazy krótkiego limitu czasu, w której odpowiedzi nie są rejestrowane i nie jest dostarczana stymulacja. Jest to powtarzane dla serii 10-15 różnych rosnących lub malejących częstotliwości, w przyrostach 0,05 jednostki logarytmicznej, które mieszczą się w zakresie od 20 do 200 Hz.
Podczas gdy amplituda stymulacji wpływa na to, które neurony są stymulowane, częstotliwość stymulacji określa szybkość wyzwalania indukowaną w tej populacji neuronów. Ogólnie rzecz biorąc, zwiększenie częstotliwości stymulacji zwiększa szybkość wypalania w docelowej populacji. Wiąże się to z wyższymi wskaźnikami odpowiedzi ICSS, ostatecznie osiągając maksymalny poziom przy maksymalnej szybkości wyzwalania, ograniczonej ogniotrwałymi właściwościami neuronów.
Inne czynniki
Niezależne zmienne pociągu stymulacji i czasu trwania impulsu można również zmieniać, aby określić, jak każdy z nich wpływa na wskaźniki odpowiedzi ICSS. Dłuższe czasy trwania pociągu powodują bardziej energiczne reagowanie do pewnego momentu, po którym szybkość reakcji zmienia się odwrotnie proporcjonalnie do długości pociągu. Wynika to z naciskania dźwigni w celu dodatkowej stymulacji, zanim skończy się poprzednio zarobiony pociąg.
Harmonogram wzmacniania można również manipulować, aby określić, jak zmotywowane jest zwierzę do otrzymywania stymulacji, odzwierciedlone przez to, jak ciężko jest na to pracować. Można tego dokonać zwiększając liczbę odpowiedzi wymaganych do otrzymania nagrody (FR-2, FR-3, FR-4, itd.) lub wdrażając harmonogram ze stopniem progresywnym, w którym liczba wymaganych odpowiedzi stale rośnie. Liczba wymaganych odpowiedzi wzrasta w każdej próbie, aż zwierzę nie osiągnie wymaganej liczby odpowiedzi. Jest to uważane za „punkt przełomowy” i jest dobrym wskaźnikiem motywacji związanej z wielkością nagrody.
Analiza przesunięcia krzywej
Intensywność stymulacji, czas trwania impulsu lub częstotliwość impulsu można zmieniać w celu określenia funkcji dawka-odpowiedź ICSS przy użyciu analizy przesunięcia krzywej. Podejście to ogólnie przypomina tradycyjną farmakologiczną krzywą odpowiedzi na dawkę, w której bada się częstotliwość stymulacji, a nie dawkę leku. Metoda ta pozwala na ilościową analizę terapii modulujących nagrodę na podstawie wskaźników odpowiedzi w porównaniu do warunków wyjściowych. Niższe częstotliwości stymulacji nie są w stanie utrzymać odpowiedzi ICSS z prawdopodobieństwem powyżej szansy. Wskaźniki odpowiedzi szybko rosną w dynamicznym zakresie częstotliwości stymulacji wraz ze wzrostem częstotliwości, aż do osiągnięcia maksymalnego wskaźnika odpowiedzi. Zmiany w szybkości odpowiedzi w tym zakresie odzwierciedlają zmiany w wielkości nagrody. Funkcje częstości-częstotliwości, intensywności tempa lub czasu trwania tempa pozwalają wnioskować o sile i skuteczności stymulacji, a także wyjaśniają, w jaki sposób leki zmieniają nagradzający wpływ stymulacji.
Analiza przesunięcia krzywej jest często wykorzystywana w badaniach farmakologicznych w celu porównania wyjściowych wskaźników odpowiedzi z tymi po podaniu leku. Maksymalny wskaźnik odpowiedzi w warunkach podstawowych jest zwykle używany do normalizacji danych na krzywej częstości do maksymalnego wskaźnika kontroli (MCR). Dokładniej, liczba odpowiedzi dla dowolnego badania jest dzielona przez najwyższą liczbę odpowiedzi zarejestrowaną w badaniu stanu wyjściowego, która jest następnie mnożona przez 100. W warunkach eksperymentalnych, jeśli MCR spada poniżej 100% przy najwyższych częstotliwościach stymulacji , uważa się, że odzwierciedla ona upośledzoną zdolność lub motywację do odpowiedzi, potencjalnie wywołaną przez lek o właściwościach uspokajających lub awersyjnych. Przesunięcia powyżej 100% MCR wskazują na lepszą zdolność lub motywację do odpowiedzi, potencjalnie wywołaną przez lek o właściwościach nagradzających lub pobudzających.
Wrażliwość obwodów neuronalnych na nagradzające właściwości stymulacji ocenia się, analizując przesunięcia w lewo lub w prawo w M50 lub częstotliwość, przy której zarejestrowano 50% maksymalnej liczby odpowiedzi. Osiągnięcie 50% MCR przy niższej częstotliwości jest charakterystyczne dla przesunięcia w lewo krzywej częstotliwości i uwrażliwienia obwodu nagrody na stymulację. Wzrost M50 wskazuje, że do osiągnięcia 50% MCR wymagana była większa częstotliwość stymulacji, a obwody nagrody zostały znieczulone przez eksperymentalne manipulacje. Innym sposobem analizy krzywej częstotliwości i częstotliwości między warunkami kontrolnymi a eksperymentalnymi jest wykonanie regresji liniowej przez rosnące punkty danych na wykresie danych surowych (które nie zostały znormalizowane do MCR). Punkt, w którym y=0, czyli punkt przecięcia osi x, nazywany jest częstotliwością progową lub theta zero (θ 0 ). Jest to częstotliwość, przy której wskaźniki odpowiedzi ICSS są równe 0 (a każda częstotliwość powyżej tej wartości teoretycznie wywoła odpowiedź ICSS).
Modulacja lekami
Kilka głównych klas leków zostało szeroko zbadanych w odniesieniu do zachowania ICSS: leki monoaminergiczne, opioidy, leki cholinergiczne, leki GABAergiczne, a także niewielka liczba leków z innych klas. Badania te ogólnie porównują odpowiedź ICSS na początku badania i po podaniu leku. Zazwyczaj do określenia zmian w M50 lub θ 0 stosuje się podejście oparte na częstotliwości .
Leki o zwiększonej skłonności do uzależnień generalnie obniżają próg stymulacji dla odpowiedzi ICSS, podczas gdy leki o właściwościach awersyjnych generalnie zwiększają próg stymulacji w celu uzyskania odpowiedzi ICSS. Badania te dostarczają wglądu w specyficzne mechanizmy neurochemiczne zaangażowane w facylitację BSR oraz jak postrzeganie nagrody może być modulowane poprzez farmakologiczną zmianę aktywności określonych układów neuroprzekaźników. Manipulacje farmakologiczne tych systemów mogą mieć bezpośredni lub pośredni wpływ na aktywność układu nagrody. Zrozumienie specyficznego wpływu leku na progi odpowiedzi ICSS pomogło wyjaśnić, w jaki sposób różne systemy neuroprzekaźników wpływają na obwody nagrody poprzez wzmacnianie lub tłumienie wrażliwości na stymulację nagradzania i wpływanie na motywację do wykonywania zachowań związanych z nagrodą.
BSR i leki uzależniające wywołują swoje nagradzające efekty dzięki wspólnym mechanizmom neuroanatomicznym i neurochemicznym. Badania wykorzystujące mapowanie uszkodzeń, farmakologiczne i anatomiczne mózgu wykazały, że wiele nadużywanych narkotyków (np. amfetamina , kokaina , opioidy , nikotyna itp.) aktywuje układ nagrody MFB, który jest podobnie aktywowany przez stymulację w celu osiągnięcia BSR. W aksonach z systemu mezolimbiczno-dopaminergicznego kluczowym składnikiem układu nagrodę, zwykle mają wysokie progi pobudzania. Jednak te progi można zwiększyć lub zmniejszyć przez podanie leku, wpływając na wrażliwość na stymulację wewnątrzczaszkową i zachowanie ICSS.
Leki monoaminergiczne
Skutki leków zmieniających neuroprzekaźnictwo dopaminy, noradrenaliny i serotoniny były szeroko badane w odniesieniu do BSR. Badania neurochemiczne wykazały, że BSR powoduje uwalnianie dopaminy w jądrze półleżącym. Efekt ten jest na ogół nasilany po podaniu leków, które same zwiększają ilość pozakomórkowej dopaminy w jądrze półleżącym, takich jak kokaina , która hamuje wychwyt zwrotny dopaminy do przestrzeni wewnątrzkomórkowej poprzez blokowanie jej transportera . Odwrotnie, poziomy te ulegają zmniejszeniu, a nagradzające właściwości BSR są blokowane po podaniu leków, które antagonizują receptory dopaminy lub zmniejszają ilość zewnątrzkomórkowej dopaminy, poprzez promowanie degradacji lub ponownego wychwytu neuroprzekaźnika. Chociaż dopamina jest ogólnie uważana za główny neuroprzekaźnik związany z układem nagrody, często nie jest jedynym neuroprzekaźnikiem, na który wpływają uzależniające leki monoaminergiczne. Co ważne, obwody zaangażowane w BSR są wielosynaptyczne, a nie wyłącznie dopaminergiczne. Wprowadza to potencjał modulacji przez inne układy neuroprzekaźników na różnych etapach transmisji sygnału nagrody.
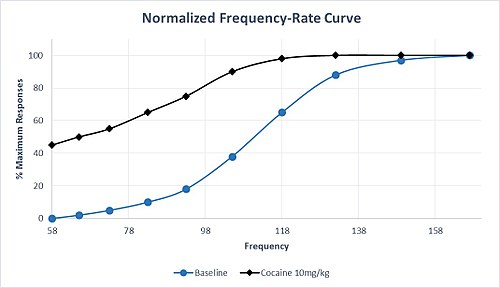
Dodatkowo leki wpływające na transmisję monoamin różnią się selektywnością. Na przykład, leki o wysokiej selektywności w zakresie zwiększania transmisji dopaminy i noradrenaliny w stosunku do transmisji serotoniny mają silne właściwości uzależniające. Amfetamina i kokaina mają ten sam profil selektywności, a podawanie tych leków generalnie powoduje przesunięcie w lewo w M50 i θ 0, co wskazuje na uczulenie układu nagrody i wysoki potencjał nadużywania. To charakterystyczne przesunięcie w lewo M50 w odpowiedzi na umiarkowaną dawkę kokainy jest zilustrowane w hipotetycznym zestawie danych na Ryc. 1. Należy zauważyć, że maksymalny wskaźnik odpowiedzi jest osiągany z mniejszą częstotliwością niż w punkcie wyjściowym i jest znacząca odpowiedź z najniższą częstotliwością, która nie powodowała odpowiedzi w warunkach wyjściowych. Nawet po przewlekłym podawaniu metamfetaminy lub kokainy nie ma tolerancji na ułatwianie ICSS. Jednak po przerwaniu leczenia przewlekłego następuje wywołana odstawieniem depresja odpowiedzi ICSS, którą można odwrócić przez ponowne podanie leku.
Leki o bardziej zrównoważonej selektywności przenoszenia dopaminy/norepinefryny i serotoniny, takie jak 3,4-metylenodioksy-metamfetamina ( MDMA ), są mniej uzależniające i mają mieszany wpływ na odpowiedź ICSS w zależności od dawki i częstotliwości stymulacji. Leki selektywne względem serotoniny powodują jednak albo brak wzmocnienia ICSS, albo osłabienie odpowiedzi ICSS (przesunięcie w prawo krzywej częstości) i leki te są ogólnie uważane za mniej uzależniające. Jednym z takich przykładów jest fenfluramina, która była wcześniej sprzedawana jako środek tłumiący apetyt. Antagoniści dopaminy na ogół powodują obniżenie odpowiedzi ICSS i przesunięcie w prawo na krzywej częstości. Sugeruje to zmniejszenie BSR i prawdopodobnie zwiększone awersyjne właściwości stymulacji. Po długotrwałym leczeniu antagonistą dopaminy następuje wywołane odstawieniem ułatwienie ICSS, efekt odwrotny do obserwowanego po długotrwałym leczeniu środkami pobudzającymi.
Opioidy
Leki działające na układ opioidowy na ogół różnią się selektywnością względem receptorów opioidowych mu (μ), delta (δ) i kappa (κ). Ich właściwości uzależniające są silnie uzależnione od tych selektywności. Ogólnie rzecz biorąc, agoniści receptora opioidowego mi (MOR) o dużej sile działania mają wysoki potencjał nadużywania, podczas gdy agoniści receptora opioidowego kappa (KOR) na ogół wywołują stan dysforyczny. Morfina, agonista MOR, była jednym z najwcześniej badanych leków na początku ICSS i BSR. Silni agoniści MOR, tacy jak morfina, mają nieco zróżnicowany wpływ na odpowiedź ICSS, pomimo wysokiego potencjału nadużywania, powodując zarówno nasilenie, jak i depresję. Stwierdzono, że wpływ tych leków na odpowiedź ICSS jest wysoce zależny od dawki, czasu przed leczeniem i wcześniejszej ekspozycji na opioidy. Różne badania nad wpływem leków selektywnych względem MOR, w tym morfiny, heroiny, fentanylu, metadonu i hydrokodonu, wykazały mieszany wpływ na odpowiedź ICSS. Stwierdzono, że niskie dawki tych leków powodują słabe ułatwienie ICSS, podczas gdy wysokie dawki powodują dwufazowy profil ICSS, składający się z wyższego progu ICSS przy niższych częstotliwościach, a następnie wzmocnienia ICSS przy wyższych częstotliwościach. Przy długotrwałym podawaniu silnych agonistów MOR w małych dawkach nie ma tolerancji na ICSS.
Antagoniści receptora opioidowego, tacy jak nalokson , mogą odwracać wpływ zarówno agonistów receptora opioidowego na odpowiedź ICSS, jak i nasilający wpływ psychostymulantów, takich jak metamfetamina. Nalokson, który jest konkurencyjnym antagonistą wszystkich podtypów receptorów opioidowych, nie wpływa na odpowiedź ICSS, gdy jest podawany samodzielnie. Agonizm KOR, typowo związany ze stanami dysforycznymi, bardziej konsekwentnie skutkuje depresją odpowiedzi ICSS. Na przykład agonista KOR, salwinorin-A, powoduje ogólny spadek wskaźników odpowiedzi ICSS przy niższych częstotliwościach stymulacji. Wielokrotne podawanie nie powoduje tolerancji na depresję ICSS. Wpływ agonistów/antagonistów receptora opioidowego delta (DOR) na ICSS jest mniej jasny. Stwierdzono, że jeden agonista DOR, SNC80, powoduje depresję ICSS, ale istnieją przeciwne dowody sugerujące, że niektórzy agoniści delta mogą mieć słabe właściwości ułatwiające ICSS.
Leki cholinergiczne
Leki cholinergiczne były mniej intensywnie badane niż monoaminy i opioidy. Najczęściej badanym lekiem cholinergicznym jest nikotyna , silnie uzależniająca substancja psychoaktywna zawarta w papierosach. Nikotyna jest agonistą nikotynowych receptorów acetylocholiny (nAchR), które są kanałami jonowymi bramkowanymi ligandami. Stwierdzono, że uzależniające właściwości nikotyny są związane z agonizmem, szczególnie podtypu α4β2 receptorów nikotynowych. Wiele badań potwierdziło, że niskie dawki nikotyny powodują ułatwienie ICSS, podczas gdy wyższe dawki powodują depresję ICSS. Przewlekłe leczenie nikotyną nie powoduje tolerancji na działanie ICSS przy niskich dawkach, ale powoduje tolerancję na depresyjne działanie wysokich dawek. Obserwuje się również indukowaną odstawieniem depresję ułatwiania ICSS przy niskich dawkach, podobnie jak w przypadku agonistów MOR i stymulantów monoaminowych. Wpływ leczenia nikotynowego na progi odpowiedzi ICSS i maksymalne wskaźniki odpowiedzi nie są tak znaczące, jak w przypadku wielu uzależniających agonistów MOR i stymulantów monoaminowych.
Leki GABAergiczne
Transmisja GABAergicznego działa hamująco i dwóch głównych receptorów GABA są GABA i GABA B . Leki, które działają na GABA A, receptory, które są kanałami jonowymi bramkowane ligandem, są bardziej intensywnie badane, ponieważ na ogół uzyskuje bardziej niezawodne działanie na uspokojenie i niepokoju , i są często stosowane do celów terapeutycznych. Kilka z tych leków ma właściwości uzależniające, w tym kilka benzodiazepin i barbituranów . Niskie dawki tych leków na ogół powodują ułatwienie ICSS, podczas gdy wyższe dawki mogą skutkować depresją ICSS i ogólnym zmniejszeniem maksymalnego wskaźnika odpowiedzi. To ostatnie jest prawdopodobnie związane z upośledzoną zdolnością reagowania z powodu uspokajających i hipnotycznych właściwości tych leków. Etanol wpływa na aktywność receptora GABA i stwierdzono, że umiarkowanie ułatwia ICSS, pomimo starszych publikacji sugerujących, że wyniki te są niespójne.
GABA B agoniści receptora i dodatnie allosteryczne modulatory okazały się prowadzić do depresji ICSS i stwierdzono, że hamują wzmacniające działanie wielu leków, włącznie z kokainą, metamfetamina i nikotyny odwrócenie ułatwienia ICSS leki te zazwyczaj powodować.
Dowody kliniczne i przedkliniczne
Mechanizmy BSR oferują narzędzie, które zapewnia wgląd w sposób, w jaki mózg kieruje zachowaniem poprzez motywację i wzmocnienie, szczególnie w odniesieniu do zachowań uzależniających i kompulsywnych. Badania ICSS nad BSR okazały się solidną miarą wrażliwości na nagrodę i mogą pomóc w ocenie podatności na nadużycia różnych przyszłych leków. Ponadto badania ICSS mogą być wykorzystane do oceny, w jaki sposób na wrażliwość na nagrodę wpływają czynniki genetyczne związane z zaburzeniami uzależnienia. Stwierdzono, że leki zapobiegające facylitacji ICSS mogą być opracowywane i wdrażane terapeutycznie w celu zmniejszenia ryzyka zaburzeń uzależnieniowych w warunkach klinicznych.
Zobacz też
- Nagroda
- Głęboka stymulacja mózgu
- Uzależnienie behawioralne
- Wzmacniacz
- Dr José Manuel Rodriguez Delgado
- dr Robert Heath
- Dr James Olds
- Dr Wilder Penfield
- Samozarządzanie
- Neuronauka behawioralna
Bibliografia
Linki zewnętrzne
- Stymulacja mózgu: czy impulsy magnetyczne lub elektryczne mogą ci pomóc? : Celowanie w niewłaściwie zachowujące się obwody mózgowe za pomocą terapii, takich jak ECT, DBS i TMS
- Głęboka stymulacja mózgu : zabiegi neurochirurgiczne z wykorzystaniem głębokiej stymulacji mózgu
- Narkotyki a mózg : narkotyki, mózg, zachowanie – nauka o uzależnieniu