Fluorek miedzi(II) - Copper(II) fluoride
|
|

|
|

|
|

|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Difluorek miedzi
|
|
| Inne nazwy
fluorek miedzi; fluorek miedzi; Difluorek miedzi (2+)
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA |
100.029.225 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| Cu F 2 | |
| Masa cząsteczkowa | 101,543 g/mol (bezwodny) 137,573 g/mol (dihydrat) |
| Wygląd | Biały krystaliczny proszek Po uwodnieniu : niebieski |
| Gęstość | 4,23 g / cm 3 (bezwodna) 2,934 g / cm 3 (dwuwodzianu) |
| Temperatura topnienia | 836 °C (1,537 °F; 1,109 K) (bezwodny) 130 °C (dihydrat, rozkłada się) |
| Temperatura wrzenia | 1676 ° C (3049 ° F; 1949 K) (bezwodny) |
| Rozpuszczalność w innych rozpuszczalnikach | Higroskopijny |
| +1050,0·10 -6 cm 3 /mol | |
| Zagrożenia | |
| NIOSH (limity ekspozycji dla zdrowia w USA): | |
|
PEL (dopuszczalne)
|
TWA 1 mg/m 3 (jako Cu) |
|
REL (zalecane)
|
TWA 1 mg/m 3 (jako Cu) |
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
TWA 100 mg/m 3 (jako Cu) |
| Związki pokrewne | |
|
Inne aniony
|
Bromek miedzi(II) Chlorek miedzi(II) |
|
Inne kationy
|
Fluorek srebra(II) Fluorek kobaltu(II) |
|
Związki pokrewne
|
Fluorek miedzi(I) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Fluorek miedzi(II) jest związkiem nieorganicznym o wzorze chemicznym CuF 2 . Jest to białe, krystaliczne, higroskopijne ciało stałe o strukturze krystalicznej typu rutylu , podobnej do innych fluorków o wzorze chemicznym MF 2 (gdzie M oznacza metal).
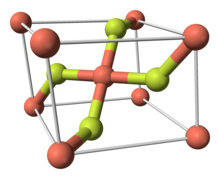
Struktura
Fluorek miedzi(II) ma jednoskośną strukturę krystaliczną i nie może osiągnąć struktury o większej symetrii. Tworzy prostokątne graniastosłupy o podstawie równoległoboku.
Zastosowania
Fluorek miedzi (II) można stosować do wytwarzania fluorowanych węglowodorów aromatycznych w reakcji z węglowodorami aromatycznymi w atmosferze zawierającej tlen w temperaturach powyżej 450 °C (842 °F). Ta reakcja jest prostsza niż reakcja Sandmeyera , ale jest skuteczna tylko w wytwarzaniu związków, które mogą przetrwać w stosowanej temperaturze. Reakcja sprzężona z użyciem tlenu i 2 HF regeneruje fluorek miedzi(II), wytwarzając wodę. Metoda ta została zaproponowana jako „bardziej ekologiczna” metoda wytwarzania związków fluoroaromatycznych, ponieważ pozwala uniknąć wytwarzania toksycznych produktów odpadowych, takich jak fluorek amonu .
Chemia
Fluorek miedzi(II) można zsyntetyzować z miedzi i fluoru w temperaturze 400 °C (752 °F). Występuje jako bezpośrednia reakcja.
- Cu + F 2 → CuF 2
Traci fluor w stanie stopionym w temperaturach powyżej 950°C (1742°F).
- 2CuF 2 → 2CuF + F 2
- 2CuF → CuF 2 + Cu
Złożone aniony CuF 3 − , CuF 4 2− i CuF 6 4− powstają, gdy CuF 2 jest wystawiony na działanie substancji zawierających jony fluorkowe F − .
Rozpuszczalność
Miedź (II), fluorek jest słabo rozpuszczalny w wodzie, ale zaczyna się rozkładać, gdy znajduje się w gorącej wodzie, tworząc podstawową F - i jonów Cu (OH).
Toksyczność
Niewiele jest szczegółowych informacji na temat toksyczności fluorku miedzi(II). Jednak zarówno miedź, jak i fluor mogą być toksyczne, gdy są spożywane.
Toksyczność miedzi może wpływać na skórę, oczy i drogi oddechowe. Poważne stany obejmują gorączkę metaliczną i hemolizę czerwonych krwinek. Miedź może również powodować uszkodzenie wątroby i innych głównych narządów.
Fluorki metali są ogólnie bezpieczne w niskich stężeniach i są dodawane do wody w wielu krajach w celu ochrony przed próchnicą. Na wyższych poziomach mogą powodować efekty toksyczne , od nudności i wymiotów po drżenie, problemy z oddychaniem, poważne konwulsje, a nawet śpiączkę. Może to spowodować uszkodzenie mózgu i nerek. Przewlekłe narażenie może powodować utratę gęstości kości, utratę wagi i anoreksję.
Zagrożenia
Eksperymenty z fluorkiem miedzi(II) należy przeprowadzać pod wyciągiem, ponieważ mogą wystąpić opary tlenku metalu. Połączenie kwasów z fluorkiem miedzi(II) może prowadzić do powstania fluorowodoru , który jest wysoce toksyczny i żrący.
Bibliografia
- C. Billy; HM Haendlera (1957). „Struktura krystaliczna fluorku miedzi (II)”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 79 (5): 1049–51. doi : 10.1021/ja01562a011 .
- PC de Mello; M. Hehenberga; S. Larsona; M. Zernera (1980). „Badania struktury elektronowej fluorków miedzi i chlorków miedzi”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 102 (4): 1278–1288. doi : 10.1021/ja00524a010 .
- HM Haendlera; LH Towle; EF Bennetta; WL Patterson (1954). „Reakcja fluoru z miedzią i niektórymi jej związkami. Niektóre właściwości fluorku miedzi (II)”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 76 (8): 2178–2179. doi : 10.1021/ja01637a039 .
- TC Ehlert; JS Wang (1977). „Termochemia fluorków miedzi”. Czasopismo Chemii Fizycznej . 81 (22): 2069-2073. doi : 10.1021/j100537a005 .
- Dierks, S. „Fluor miedzi”. http://www.espimetals.com/index.php/msds/537-copper-fluoride (dostęp 9 października).
- podramański, magister ; Manzer, LE (2002). „Zielona” droga syntetyczna dla fluoroaromantyków poprzez fluorek miedzi (II)”. Nauka . 297 (5587): 1665. doi : 10.1126/science.1076397 . PMID 12215637 . S2CID 32697750 .
- Olejniczak, I.; Wolak, J.; Barszcz B.; Schlueter, J.; Manson, J. (2010). „CuF 2 Zmiany strukturalne w dwuwymiarowym magnesie kwantowym (H 2 O) 2 (pyz) pod ciśnieniem: Badanie Ramana”. Materiały z konferencji AIP . 1267 (1): 597-598. doi : 10.1063/1.3482697 .
- Kent, RA; Mcdonalda, JD; Margrabia JL (1966). „Badania spektrometrii masowej w wysokich temperaturach. IX. Ciśnienie sublimacji fluoru miedzi (II)”. Czasopismo Chemii Fizycznej . 70 (3): 874-877. doi : 10.1021/j100875a042 .
- Szaszkin, SY; Goddard III, Waszyngton (1986). „Efekty korelacji elektronowej w parametrach pola ligandu i innych właściwościach fluorku miedzi II”. Czasopismo Chemii Fizycznej . 90 (2): 250–255. doi : 10.1021/j100274a010 .

