Rak surowiczy wysokiego stopnia - High-grade serous carcinoma
| Rak surowiczy o wysokim stopniu złośliwości | |
|---|---|
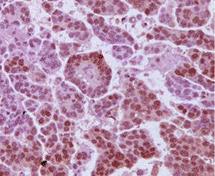 | |
| Mikrografia immunohistochemiczna receptorów androgenowych na próbce guza HGSC |
Rak surowiczy wysokiego stopnia ( HGSC ) to rodzaj nowotworu, który powstaje z nabłonka surowiczego w jamie brzuszno-miednicy i występuje głównie w jajniku . HGSC stanowią większość przypadków raka jajnika i mają najniższe wskaźniki przeżywalności. HGSC różni się od raka surowiczego o niskim stopniu złośliwości (LGSC), który powstaje z tkanki jajnika, jest mniej agresywny i występuje w raku jajnika w stadium I, w którym guzy są zlokalizowane w jajniku.
Chociaż pierwotnie sądzono, że pochodzi z warstwy komórek nabłonka płaskiego pokrywającej jajnik, obecnie uważa się, że HGSC pochodzi z nabłonka jajowodu. HGSC jest znacznie bardziej inwazyjny niż LGSC z wyższym wskaźnikiem śmiertelności - chociaż jest bardziej wrażliwy na chemioterapię opartą na platynie , prawdopodobnie z powodu szybkiego tempa wzrostu. W rzadkich przypadkach HGSC mogą rozwinąć się z LGSC, ale generalnie te dwa typy powstają niezależnie od siebie.
Czynniki ryzyka
Środowiskowe czynniki ryzyka
Na teorię „nieustannej owulacji ” przemawia silna korelacja pomiędzy liczbą cykli owulacyjnych danej osoby a ryzykiem raka jajnika.
Tendencja ta znajduje odzwierciedlenie w ochronnym działaniu ciąży, porodu i karmienia piersią przed rakiem jajnika oraz podobnych wynikach badań epidemiologicznych, które wskazały na zmniejszenie ryzyka związanego ze stosowaniem doustnych tabletek antykoncepcyjnych.
Uważa się, że owulacja jest przyczyną torbieli wtrętowych kory jajnika, zmian prekursorowych raka surowiczego, a niższa liczba tych cyst wtrętowych kory mózgowej jest uważana za mechanizm, dzięki któremu zmniejszenie owulacji w ciągu całego życia może zmniejszyć ryzyko rozwoju HGSC.
Odwrotnie, stwierdzono czasowy związek z hormonoterapią menopauzalną i występowaniem HGSC i wykazano, że zespół policystycznych jajników (PCOS) przyczynia się do podwojenia ryzyka raka jajnika.
Endometrioza może zwiększać ryzyko innych podtypów raka jajnika, ale nie jest związana z HGSC.
Genetyczne czynniki ryzyka
Ponad 20% guzów raka jajnika ma pochodzenie dziedziczne . Większość z nich obejmuje mutacje w genach supresorowych nowotworów BRCA , które mają tendencję do wywoływania HGSC. Mutacja w genach BRCA1 lub BRCA2 może powodować ryzyko raka jajnika w ciągu całego życia odpowiednio o 40-50% i 10-20%, przy czym mutacje BRCA2 są silnie związane z lepszymi wynikami klinicznymi.
Uważa się, że specyficzny wzór ekspresji białka nowotworowego 53 ( TP53 ) w nabłonku jajowodu - „sygnatura p53” - jest markerem prekursorowym HGSC. Myszy TP53 - / - (u których usunięto gen TP53) nie rozwijają raka jajnika. Jednak mutacje TP53 stwierdzono w 96% przypadków HGSC. Lokalna nieprawidłowa ekspresja TP53 może zatem wskazywać na HGSC. U kobiet HGSC w miednicy wykazuje całkowity brak ekspresji P53 lub nadekspresję, co sugeruje, że jakakolwiek aberracja P53 prowadzi do rozwoju guza. Ponadto nadekspresja TP53 wiąże się z lepszymi wynikami klinicznymi, podczas gdy brak białka p53 wiąże się ze zwiększonym ryzykiem nawrotu guza HGSC.
Niedawny model mysi sugeruje, że mutacja p53 może indukować HGSC powstający z jajnika, a nie z jajowodu.
Patofizjologia
Pochodzenie komórki
HGSC są ponadto odróżniane od LGSC na podstawie nomenklatury nowotworów jajnika „typu I / II”; typ I odnoszący się do typów nowotworów (np. LGSC), w których scharakteryzowano zmiany prekursorowe w jajniku, oraz typ II odnoszący się do typów nowotworów (np. HGSC) bez powiązania takich zmian, guzy, które mogą rozwijać się de novo z jajowodów i / lub jajników nabłonek powierzchniowy. Ta klasyfikacja ma większe znaczenie dla badań niż dla praktyki klinicznej.
Surowiczy membrana jest szczególnym rodzajem wydzielniczych nabłonka który obejmuje organy w jamach ciała i wydziela surowiczych płynu, aby zmniejszyć tarcie z ruchu mięśni. Błona surowicza wyściełająca jamę brzuszno-miedniczną nazywana jest otrzewną ; że wyściółką serca i śródpiersia jest osierdzie , a wyściółką klatki piersiowej i płuc jest opłucna . Z technicznego punktu widzenia „rak surowiczy” może wystąpić w dowolnym miejscu na tych błonach, ale rak surowicze o wysokim stopniu złośliwości jest na ogół ograniczony do obszaru otrzewnej.
Chociaż do niedawna sądzono, że HGSC powstaje w wyniku prostego różnicowania cyst inkluzyjnych korowych (CIC) nabłonka powierzchniowego jajnika (OSE), pochodzenie komórkowe HGSC jest obecnie rozumiane jako znacznie bardziej złożone, z dowodami na inne miejsca pochodzenia, zarówno w - i poza jajnikami, które wyszły na jaw.
| Papierowa chusteczka | Dowody na rolę komórki pochodzenia HGSC |
|---|---|
| Jajnik |
Wspierający:
Przeciwny:
|
| Nabłonek celomiczny |
Wspierający:
`` Hipoteza celomiczna ''
Przeciwny:
|
| jajowód |
Wspierający:
Przeciwny:
|
| Nabłonek Müllera pozamaciczny (EUME) |
Wszystkie nabłonki żeńskich narządów płciowych - jajowody, endometrium , endocervix , ectocervix , górna pochwa - pochodzą z embrionalnych przewodów Müllera. Nabłonek Müllera pozamaciczny obejmuje dystalny koniec jajowodów (fimbrie) oraz przypadki endosalpingiozy , endometriozy i endocervicosis.
Wspierający:
Przeciwny:
|
| Granica między jajnikiem a jajowodem (strefa przejściowa) |
Wspierający:
Przeciwny:
|
Powszechne Müllerowskie pochodzenie jajowodów, macicy, szyjki macicy i górnej części pochwy doprowadziło do wniosku, że rak surowiczy wysokiego stopnia otrzewnej jest spektrum pojedynczej choroby.
Odpowiednie modele zwierzęce HGSC można opracować tylko wtedy, gdy pochodzenie komórki jest właściwie poznane. Jednakże, ponieważ HGSC ma zwykle takie same zachowanie kliniczne, niezależnie od pierwotnego pochodzenia komórkowego, określenie pochodzenia komórek jest mniej ważne w leczeniu klinicznym, ale może mieć znaczenie przy poszukiwaniu biomarkerów.
Specyficzny proces, w wyniku którego powstaje HGSC, może być związany ze statusem mutacji BRCA osobnika, jak również statusem mutacji p53.
W artykule z 2007 roku opisano proces określania pochodzenia komórki jako „Pochodzenie guza jest zwykle przypisywane do narządu wykazującego dominującą masę guza. Jedynym wyjątkiem jest otrzewna, która jest klasyfikowana jako pierwotna lokalizacja tylko wtedy, gdy kandydujące pochodzenie nie zostanie znalezione w endometrium, rurce lub jajniku ”.
Uznaje się, że HGSC może mieć zmienne i złożone pierwotne pochodzenie, ale zrozumienie tego i określenie tego da wgląd w jego patogenezę.
Patogeneza
Zakładając pochodzenie fimbrialne, jak obserwuje się w większości przypadków HGSC, obecne zrozumienie genezy HGSC sugeruje proces, w którym komórki fimbrialne STIC wszczepiają się do jajnika w postaci torbieli korowych wtrętowych przez miejsce pęknięcia owulacji.
Aby uwzględnić przypadki, w których nie występuje zajęcie STIC, możliwe jest również wystąpienie endosalpingiozy lub metaplazji de novo w nabłonku powierzchniowym jajnika. Znacznie rzadszym zjawiskiem jest różnicowanie HGSC od LGSC.
Diagnoza
Objawy obejmują utrzymujące się wzdęcia , krwawienia pomenopauzalne i / lub utratę apetytu.
Ultrasonografia przezpochwowa oraz analiza poziomu markera nowotworowego CA125 są często wykorzystywane do określenia potencjalnej złośliwości podejrzanych guzów miednicy.
Chirurgiczne pomostowy jest procedura, według której jamy brzusznej i węzły chłonne są badane dla tkanki nowotworowej, zwykle poprzez laparoskopii . Do dalszej analizy można pobrać biopsje tkanek . Dopiero na tym etapie analizy histologicznej można postawić właściwą diagnozę HGSC.
Jeśli gruczoły zrastają się ze skomplikowanymi, rozległymi brodawkami z kępkami nabłonka z litymi gniazdami otoczonymi przestrzenią wzdłuż nieregularnych szczelin przypominających szczeliny, podejrzewa się raka surowiczego.
Rozróżnienie między LGSC i HGSC:
- Martwica jest powszechna w HGSC i nie występuje w LGSC, podobnie jak olbrzymie (wielo- lub jednojądrzaste) komórki nowotworowe.
- Ciała Psammoma występują częściej w raku surowiczym o niskim stopniu złośliwości.
- Ekspresję Tp53 ocenia się pod kątem mutacji, nadekspresji lub braku - typowych cech raków surowiczych wysokiego stopnia.
- LGSC są na ogół ograniczone do wzorców wzrostu mikropapilarnego, podczas gdy HGSC mogą wykazywać wzorce mieszane.
Nie zawsze można odróżnić HGSC od raka endometrioidalnego o wysokim stopniu złośliwości.
Progresję HGSC można również określić na podstawie badania profilu ekspresji kadheryny .
Ekranizacja
Ponieważ rak jajnika rzadko daje objawy aż do zaawansowanego stadium, regularne prewencyjne badania przesiewowe są szczególnie ważnym narzędziem pozwalającym uniknąć późnego stadium, w którym zgłasza się większość pacjentek. Jednak badanie USG z 2011 roku wykazało, że przezpochwowe badanie ultrasonograficzne i badanie przesiewowe markera raka CA125 nie zmniejszyło śmiertelności z powodu raka jajnika. Z kolei nowsze badanie przeprowadzone w Wielkiej Brytanii wykazało, że nawet 20% zgonów z powodu raka jajnika można by zapobiec poprzez coroczne wykonywanie tych procedur.
Zapobieganie
Profilaktyka dla osoby uznane za zagrożone HGSC ma, aż do niedawna był (dwustronne lub jednostronne) usuwanie zarówno jajnika i jajowodu (salpingo- jajników ).
W przypadku problemów hormonalnych, a nawet chorobowości wynikających z usunięcia jajników, oraz coraz większej liczby dowodów na rolę patogenezy HGSC jajowodów, optymalizacja tej procedury polegała na usunięciu tylko jajowodu (jajowodów) (salpingektomia), a jajniki pozostały do wieku menopauza - chociaż krytycy twierdzą, że zmniejszony dopływ krwi do jajników może i tak wywołać przedwczesną menopauzę.
Profilaktyczna salpingooforektomia jest często wykonywana u nosicieli mutacji BRCA1 lub BRCA2, chociaż korzyści płynące z tej procedury mogą się różnić w zależności od konkretnej mutacji.
Podwiązanie jajowodów jest mniej inwazyjnym leczeniem profilaktycznym, co do którego wykazano, że znacznie zmniejsza ryzyko HGSC.
Leczenie
Cytoredukcyjne „ odciążającej ” operacja może być wykonywana przed rozpoczęciem chemioterapii w celu zmniejszenia masy fizycznej nowotworu i w ten sposób zmniejszenia liczby cykli potrzebnych chemioterapii. Typowa zaawansowana prezentacja, jak również rozprzestrzenianie się poza jajnikiem obserwowane w HGSC mogą wymagać agresywnych procedur odciążających. W niektórych przypadkach zostanie wykonana całkowita histerektomia brzuszna , w innych, gdy pacjentka zamierza urodzić dzieci, zamiast tego wykonuje się salpingo-jajnik.
Typowa chemioterapia to sześć cykli uzupełniającej chemioterapii na bazie platyny podawanej dootrzewnowo z zastosowaniem takich środków, jak karboplatyna . Pomiary poziomu CA125 we krwi służą do określenia odpowiedzi pacjenta na leczenie.
Od 20% do 30% pacjentów dochodzi do nawrotów w ciągu sześciu miesięcy leczenia.
Innym możliwym sposobem leczenia są inhibitory polimerazy rybozowej Poly ADP (PARP), przy czym nośniki mutacji BRCA1 / 2 są najbardziej wrażliwe
Epidemiologia
Badanie wskaźników zachorowalności w Stanach Zjednoczonych w latach 1992-1999 wykazało, że współczynnik zachorowalności na HGSC w zależności od wieku podwaja się co 10 lat do wieku 55 lat, gdzie utrzymuje się na poziomie około 20 przypadków na 100 000 kobiet - po czym dramatycznie spada po osiągnięciu wieku 75 lat.
Wskaźniki zachorowalności na raka jajnika są niskie w Azji Wschodniej, a najwyższe w Europie, Stanach Zjednoczonych i Australii / Nowej Zelandii.
Od 1975 r. Wskaźniki przeżywalności raka jajnika stale się poprawiały, ze średnim spadkiem o 51% do 2006 r. Ryzyka zgonu z powodu raka jajnika w zaawansowanym stadium guza. Wzrost był głównie spowodowany pomyślnym wydłużeniem oczekiwanej długości życia dotkniętych pacjentów, a nie poprawą wskaźników wyleczeń.
Istnieją różnice rasowe między czarnymi i białymi kobietami w USA, gdzie czarne kobiety są bardziej narażone na śmiertelność z powodu raka jajnika.

