PAC-1 - PAC-1
Ten artykuł dotyczy cząsteczki przeciwnowotworowej, a nie przeciwciała specyficznego dla aktywacji integryny a2iib3 o tej samej nazwie
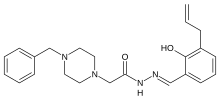 | |
| Identyfikatory | |
|---|---|
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| ChemSpider | |
| UNII | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.164.322 |
| Dane chemiczne i fizyczne | |
| Formuła | C 23 H 28 N 4 O 2 |
| Masa cząsteczkowa | 392,503 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
| (zweryfikować) | |
PAC-1 ( pierwszy związek aktywujący prokaspazę ) to zsyntetyzowany związek chemiczny, który selektywnie indukuje apoptozę w komórkach nowotworowych . W 2016 roku FDA przyznała mu status leku sierocego .
Historia
PAC-1 został odkryty w laboratorium profesora Paula Hergenrothera na Uniwersytecie Illinois w Urbana-Champaign podczas procesu, który badał wiele substancji chemicznych pod kątem potencjału przeciwnowotworowego. Ta cząsteczka, po dostarczeniu do komórek rakowych, sygnalizuje komórkom samozniszczenie poprzez aktywację białka „wykonawczego”, prokaspazy-3 . Następnie aktywowane białko kata rozpoczyna kaskadę zdarzeń, która niszczy maszynerię komórki. W 2011 roku założono Vanquish Oncology Inc., aby przenieść PAC-1 do badań klinicznych na ludziach. W 2013 roku Vanquish ogłosił wielomilionową inwestycję aniołów w firmę. W 2015 r. rozpoczęto fazę I badania klinicznego PAC-1 w celu włączenia pacjentów onkologicznych, a w 2016 r. ogłoszono, że PAC-1 otrzymał przez FDA oznaczenie leku sierocego do leczenia glejaka , a pod koniec 2017 r. Badanie 1b rozpoczęło PAC-1 plus temozolomid w leczeniu pacjentów z nawracającym glejakiem lub gwiaździakiem anaplastycznym.
Mechanizm akcji
W komórkach białko kata, kaspaza-3, jest przechowywane w swojej nieaktywnej postaci, prokaspaza-3. W ten sposób komórka może szybko przejść apoptozę poprzez aktywację białka, które już tam jest. Ta nieaktywna forma nazywana jest zymogenem . Wiadomo, że prokaspaza-3 jest hamowana przez niski poziom cynku. PAC-1 aktywuje prokaspazę-3 poprzez chelatowanie cynku, łagodząc w ten sposób hamowanie za pośrednictwem cynku. Dzięki temu prokaspaza-3 może być aktywnym enzymem, a następnie może rozszczepiać inną cząsteczkę prokaspazy-3 do aktywnej kaspazy-3. Kaspaza-3 może dodatkowo aktywować inne cząsteczki prokaspazy-3 w komórce, powodując wykładniczy wzrost stężenia kaspazy-3. PAC-1 ułatwia ten proces i powoduje, że komórka szybko przechodzi apoptozę.
Ten bezpośredni sposób aktywacji prokaspazy-3 dla PAC-1 został potwierdzony przez inne laboratoria: w 2013 r. przez laboratorium Megeney w trakcie badań nad rolą kaspazy-3 w kardiomiocytach, w 2014 r. przez laboratorium Wu w obszerne badanie aktywności przeciwnowotworowej i sposobu działania PAC-1 i pochodnych, a w 2015 roku laboratorium Gandhiego w badaniu potencjału PAC-1 i pochodnej B-PAC-1 w leczeniu przewlekłej białaczki limfocytowej (PBL).
Badania z komórkami knockout sugerowały znaczenie prokaspazy-7 jako drugorzędowego lub alternatywnego celu dla PAC-1, zwłaszcza przy braku prokaspazy-3. Na przykład eksperymenty z użyciem mysich fibroblastów embrionalnych (MEF) pokazują, że podwójny nokaut genów CASP3 i CASP7 prowadzi do komórek, które są niewrażliwe na działanie proapoptotyczne związków z klasy PAC-1 i ponownie nokautują CASP3 lub CASP7 uwrażliwia te komórki na związki typu PAC-1. Ostatnie eksperymenty z użyciem linii komórek rakowych z delecją CASP3 CRISPR są również zgodne z tym wynikiem. Aktywacja prokaspazy-7 przez PAC-1 jest zgodna z danymi biochemicznymi, chociaż względne znaczenie celu prokaspazy-7 w komórkach z funkcjonalną prokaspazą-3 jest niepewne.
Potencjalny problem selektywności powstaje, ponieważ prokaspaza-3 jest obecna w większości komórek ciała. Wykazano jednak, że w wielu nowotworach, w tym w niektórych nerwiakach niedojrzałych , chłoniakach , białaczkach , czerniakach i rakach wątroby , prokaspaza-3 występuje w wyższych stężeniach. Na przykład komórki raka płuc mogą mieć ponad 1000 razy więcej prokaspazy-3 niż normalne komórki. Dlatego kontrolując dawkowanie, można osiągnąć selektywność między komórkami prawidłowymi i rakowymi.
Wykazano, że oprócz samodzielnego działania PAC-1 wykazuje również znaczną synergię z różnymi zatwierdzonymi lekami przeciwnowotworowymi, na przykład z inhibitorami BRAF i MEK w mysich modelach czerniaka oraz z konwencjonalnymi środkami chemioterapeutycznymi, takimi jak doksorubicyna u zwierząt domowych. psy z samoistnymi nowotworami , w tym chłoniakiem i kostniakomięsakiem z przerzutami , oraz temozolomid u psów z naturalnie występującym glejakiem .
Firma Vanquish Oncology poinformowała o zamiarze rozpoczęcia badania klinicznego I fazy u pacjentów chorych na raka na początku 2015 r., a badanie fazy I PAC-1 rozpoczęło się w lutym 2015 r. (NCT02355535). To badanie jest prowadzone w University of Illinois Cancer Center w Chicago, w Sidney Kimmel Cancer Center w Johns Hopkins oraz w Regionals Hospital w St. Paul, MN. Próba fazy 1b PAC-1 plus temozolomid została otwarta pod koniec 2017 r. w tych samych trzech ośrodkach (NCT03332355); Do badania kwalifikują się pacjenci z wysokim stopniem złośliwości glejaka (glejaka wielopostaciowego (GBM) lub gwiaździaka anaplastycznego) po progresji po standardowej terapii pierwszego rzutu.
Próby na zwierzętach
PAC-1 wyróżnia się wyjątkową ścieżką, jaką przebył w klinice, ponieważ jest prawdopodobnie jedynym lekiem przeciwnowotworowym, który został po raz pierwszy poddany rygorystycznej ocenie u psów domowych z samoistnym rakiem jako wstęp do badania klinicznego na ludziach. W 2010 roku badanie wykazało, że PAC-1 jest bezpieczny dla psów, a drugie badanie opublikowane później w tym samym roku wykazało, że pochodna PAC-1 (zwana S-PAC-1) była dobrze tolerowana w małym badaniu klinicznym I fazy psy z chłoniakiem. Ostatnio, oprócz tej aktywności pojedynczego środka, PAC-1 wykazał silną synergię z zatwierdzonymi lekami przeciwnowotworowymi, na przykład z doksorubicyną w leczeniu psów domowych z chłoniakiem i kostniakomięsakiem z przerzutami oraz z temozolomidem w leczeniu psów domowych z samoistnym glejakiem .
Badania kliniczne na ludziach
PAC-1 był lub jest obecnie testowany w następujących badaniach klinicznych na ludziach:
- NCT02355535 — Związek aktywujący prokaspazę-1 (PAC-1) w leczeniu zaawansowanych nowotworów złośliwych — Składnik 1
- NCT03332355 — Związek aktywujący prokaspazę-1 (PAC-1) w leczeniu zaawansowanych nowotworów złośliwych — Składnik 2
- NCT03927248 - PAC-1 w leczeniu opornego na leczenie raka nerki z przerzutami
Bibliografia
- Peterson, QP; Goode, DR; Zachód, DC; Ramseya, KN; Lee, JJ; Hergenrother, PJ (2009). „PAC-1 aktywuje prokaspazę-3 in vitro poprzez łagodzenie hamowania za pośrednictwem cynku” . J. Mol. Biol . 388 (1): 144–158. doi : 10.1016/j.jmb.2009.03.003 . PMC 2714579 . PMID 19281821 .
- Peterson, QP; Hsu, DC; Goode, DR; Novotny, CJ; Totten, RK Hergenrother (2009). „Aktywacja prokaspazy-3 jako strategia przeciwnowotworowa: związek struktura-aktywność PAC-1 i jego kolokalizacja komórkowa z kaspazą-3” . J. Med. Chem . 52 (18): 5721–5731. doi : 10.1021/jm900722z . PMC 2749958 . PMID 19708658 .
- Łukasza, PW; Schmit, JM; Peterson, QP; Zachód, DC; Hsu, DC; Novotny, CJ; Dirikoul, L.; Deorge, DR; Garrett, LD; i in. (2011). „Farmakokinetyka i pochodzenie schematu dawkowania przeciwnowotworowego dla PAC-1, preferencyjnego aktywatora małych cząsteczek prokaspazy-3, u zdrowych psów” . Inwestować. Nowe leki . 29 (5): 901-911. doi : 10.1007/s10637-010-9445-z . PMC 3182491 . PMID 20499133 .
- Peterson, QP; Hsu, DC; Novotny, CJ; Zachód, DC; Kim, D.; Schmit, JM; Dirikolu, L.; Hergenrother, PJ; Wentylator, TM; i in. (2010). „Odkrycie i przedkliniczna ocena psów nietoksycznego związku aktywującego prokaspazę-3” . Cancer Res . 70 (18): 7232–7241. doi : 10.1158/0008-5472.can-10-0766 . PMC 3113694 . PMID 20823163 .
- Zachód, DC; Qin, Y.; Peterson, QP; Tomasz, DL; Palchaudhuri, RP; Morrisona, KC; Łukasza, PW; Palmera, AE; Wentylator, TM; i in. (2012). „Różne skutki związków aktywujących prokaspazę-3 w indukcji śmierci komórek rakowych” . Mol. Farmacja . 9 (5): 1425–1434. doi : 10.1021/mp200673n . PMC 3348238 . PMID 22486564 .
- Obama, RC; Wentylator, TM; Im, I.; Borst, L.B; Dirikolu, L.; Hergenrother, PJ (2014). „Podwójne ukierunkowanie na małe cząsteczki prokaspazy-3 radykalnie zwiększa aktywację zymogenu i aktywność przeciwnowotworową” . J. Am. Chem. Soc . 136 (4): 1312–1319. doi : 10.1021/ja4124303 . PMC 3954530 . PMID 24383395 .
Zewnętrzne linki
- Znaleziono „kata” komórki rakowej . BBC News 27 sierpnia 2006 r.
- Komórki rakowe „mogą żyć wiecznie” . BBC News 29 kwietnia 2004 r.
- Pokonaj Onkologię
- Inwestycja anioła pomaga posunąć PAC-1 do przodu
- FDA przyznaje oznaczenie leku sierocego PAC-1 na glejaka
- Badanie kliniczne fazy 1 PAC-1 u ludzi z rakiem Clinictrials.gov
