Parylen - Parylene
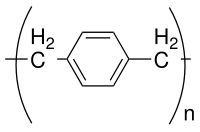
Parylen to potoczna nazwa polimeru, którego szkielet składa się z pierścieni para - benzenodiylowych – C
6H
4– połączone mostkami 1,2-etanodiylowymi – CH
2– CH
2–. Można go otrzymać przez polimeryzację para- ksylilenu H
2C = C
6H
4= CH
2.
Nazwa ta jest również używana dla kilku polimerów o tym samym szkielecie, w których niektóre atomy wodoru są zastąpione innymi grupami funkcyjnymi . Niektóre z tych wariantów są oznaczone w handlu kodami literowo-cyfrowymi, takimi jak „parylen C” i „parylen AF-4”. Niektóre z tych nazw są zarejestrowanymi znakami towarowymi w niektórych krajach.
Powłoki parylenu są często nakładane na obwody elektroniczne i inny sprzęt jako izolacja elektryczna , bariery dla wilgoci lub ochrona przed korozją i atakiem chemicznym. Stosuje się je również w celu zmniejszenia tarcia oraz w medycynie do zapobiegania niepożądanym reakcjom na wszczepione urządzenia . Powłoki te są zwykle nakładane przez osadzanie chemiczne z fazy gazowej w atmosferze monomeru para- ksylilenu.
Parylen jest uważany za „zielony” polimer, ponieważ jego polimeryzacja nie wymaga inicjatora ani innych chemikaliów do zakończenia łańcucha; a powłoki można nakładać w temperaturze pokojowej lub zbliżonej, bez rozpuszczalnika .
Historia
Parylen został odkryty w 1947 roku przez Michaela Szwarca jako jeden z produktów rozkładu termicznego para- ksylenu H
3C – C
6H
4– CH
3powyżej 1000 °C. Szwarc zidentyfikował para- ksylilen jako prekursor, obserwując, że reakcja z jodem dała jako jedyny produkt dijodek para- ksylilenu . Wydajność reakcji wynosiła tylko kilka procent.
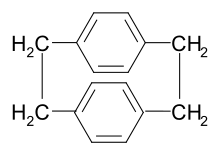
Bardziej wydajną trasę odkrył w 1965 William F. Gorham w Union Carbide. Osadzał filmy parylenowe przez rozkład termiczny [2.2] paracyklofanu w temperaturach przekraczających 550 °C iw próżni poniżej 1 Tora. Proces ten nie wymagał rozpuszczalnika i skutkował powstaniem chemoodpornych folii pozbawionych porów. Firma Union Carbide wprowadziła na rynek system powlekania parylenowego w 1965 roku.
Union Carbide kontynuowało badania nad syntezą licznych prekursorów parylenu, w tym parylenu AF-4, w latach 60. i wczesnych 70. XX wieku. Firma Union Carbide zakupiła NovaTran (powlekarkę parylene) w 1984 roku i połączyła ją z innymi przedsiębiorstwami zajmującymi się elektronicznymi powłokami chemicznymi, tworząc dział Specialty Coating Systems. Oddział został sprzedany firmie Cookson Electronics w 1994 roku.
Istnieją firmy świadczące usługi powlekania parylenem na całym świecie, ale dostępność komercyjna parylenu jest ograniczona. Prekursory [2.2]paracyklofanu można nabyć dla parylenu N, C, D, AF-4 i VT-4. Usługi Parylenu świadczone są dla N, C, AF-4, VT-4 i E (kopolimer N i E).
Odmiany
Parylen N
Parylen N jest niepodstawionym polimerem otrzymanym przez polimeryzację para- ksylilenowego produktu pośredniego.
Chlorowane paryleny
Pochodne parylenu można otrzymać przez zastąpienie atomów wodoru na pierścieniu fenylowym lub mostku alifatycznym innymi grupami funkcyjnymi. Najpopularniejszym z tych wariantów jest parylen C, który ma jeden atom wodoru w pierścieniu arylowym zastąpiony chlorem . Innym powszechnym wariantem jest parylene D, z dwoma takimi podstawieniami na pierścieniu.
Parylene C jest najczęściej stosowaną odmianą, ze względu na niski koszt jego prekursora oraz zrównoważenie jego właściwości jako właściwości dielektrycznych i barierowych dla wilgoci oraz łatwość osadzania. Główną wadą w wielu zastosowaniach jest jej nierozpuszczalność w dowolnym rozpuszczalniku w temperaturze pokojowej, co zapobiega usuwaniu powłoki, gdy część musi zostać poddana ponownej obróbce.
Parylen C jest również najczęściej używany ze względu na stosunkowo niski koszt. Może być osadzony w temperaturze pokojowej, zachowując jednocześnie wysoki stopień konformacji i jednorodności oraz umiarkowaną szybkość osadzania w procesie wsadowym.
Również chlor na pierścieniu fenylowym jednostki powtarzalnej parylenu C jest problematyczny pod względem zgodności z RoHS , zwłaszcza w przypadku wytwarzania płytek obwodów drukowanych . Co więcej, część prekursora dimeru ulega rozkładowi przez zerwanie wiązania arylo-chlor podczas pirolizy, wytwarzając materiał węglowy, który zanieczyszcza powłokę oraz chlorowodór HCl, który może uszkodzić pompy próżniowe i inny sprzęt. Atom chloru opuszcza pierścień fenylowy w rurce do pirolizy we wszystkich temperaturach; jednakże optymalizacja temperatury pirolizy zminimalizuje ten problem. Wolnorodnik (rodnik fenylowy) wytworzony w tym procesie nie jest stabilizowany rezonansowo i łagodzi osadzanie się materiału podobnego do parylenu na spodniej stronie rury do pirolizy. Materiał ten ulega zwęgleniu i generuje cząstki in situ, które zanieczyszczają czyste pomieszczenia i powodują defekty na płytkach obwodów drukowanych, które często nazywane są „podłużnicami i guzkami”. Parylene N i E nie mają tego problemu i dlatego są preferowane do produkcji i użytkowania w pomieszczeniach czystych.
Fluorowane paryleny
Innym powszechnym wariantem halogenowanym jest parylen AF-4, w którym cztery atomy wodoru w łańcuchu alifatycznym zastąpiono atomami fluoru . Ten wariant jest również sprzedawany pod nazwami handlowymi parylene SF ( Kisco ) i HT parylene ( SCS ). – CF
2– jednostka składająca się z łańcucha etylenowego jest taka sama jak powtarzająca się jednostka PTFE (teflon), co jest zgodne z jej doskonałą odpornością na utlenianie i promieniowanie UV. Parylene AF-4 został z powodzeniem zastosowany do ochrony zewnętrznych wyświetlaczy LED i oświetlenia przed wodą, solą i zanieczyszczeniami.
Innym wariantem fluorowanym jest parylen VT-4 (zwany również parylenem F), z fluorem zastąpionym czterema atomami wodoru w pierścieniu arylowym. Ten wariant jest sprzedawany przez firmę Kisco pod znakiem towarowym Parylene CF. Ze względu na alifatyczne jednostki -CH 2 - ma słabą stabilność utleniania i UV, ale wciąż lepszą niż N, C lub D.
Paryleny podstawione alkilem
Atomy wodoru mogą być również zastąpione przez grupy alkilowe . Podstawienie może nastąpić na pierścieniu fenylowym lub mostku etylenowym, lub na obu.
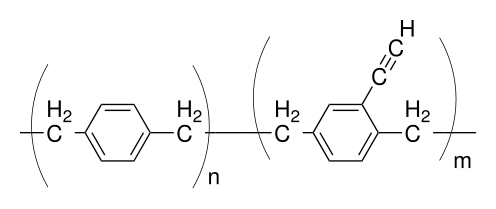
W szczególności zastąpienie jednego wodoru w pierścieniu fenylowym grupą metylową lub grupą etylową daje odpowiednio parylen M i parylen E.
Te podstawienia zwiększają odległość międzycząsteczkową (łańcuch-łańcuch), co sprawia, że polimer jest bardziej rozpuszczalny i przepuszczalny. Na przykład w porównaniu do parylene C wykazano, że parylene M ma niższą stałą dielektryczną (2,48 vs. 3,2 przy 1 kHz ). Parylen E miał niższy moduł sprężystości przy rozciąganiu (175 kpi vs 460 kpsi), niższą stałą dielektryczną (2,34 vs 3,05 przy 10 kHz), nieco gorsze właściwości barierowe dla wilgoci (4,1 vs 0,6 g-mil/atom-100 w 2-24 godz.) i równoważny rozkład dielektryczny 5-6 kvol/mil dla powłoki 1 mil), ale lepsza rozpuszczalność. Jednak kopolimer parylenu N i E ma równoważne działanie barierowe parylenu C.
Zastąpienie jednego wodoru przez metyl na każdym węglu mostka etylowego daje parylen AM-2, [–(CH
3)CH–(C
6H
4)–(CH
3)CH–]
nie(nie mylić z wariantem podstawionym grupą aminową, zastrzeżonym przez Kisco). Rozpuszczalność parylenu AM-2 nie jest tak dobra jak parylenu E.
Reaktywne paryleny
Podczas gdy powłoki parylenowe są najczęściej używane do ochrony obiektu przed wodą i innymi chemikaliami, niektóre zastosowania wymagają powłoki, która może wiązać się z klejami lub innymi powlekanymi częściami lub unieruchamiać różne cząsteczki, takie jak barwniki, katalizatory lub enzymy.
Te „reaktywne” powłoki parylenowe można otrzymać z chemicznie aktywnymi podstawnikami. Dwa dostępne na rynku produkty to parylene A, zawierające jeden podstawnik aminowy – NH
2w każdej jednostce oraz parylene AM, z jedną grupą metylenoaminową – CH
2NH
2za sztukę. (Oba są znakami towarowymi firmy Kisco.)
Parylene AM jest bardziej reaktywny niż wariant A. Amina tego ostatniego, sąsiadująca z pierścieniem fenylowym, jest stabilizowana rezonansowo, a zatem mniej zasadowa. Jednak parylene A jest znacznie łatwiejszy do syntezy, a zatem kosztuje mniej.
Innym reaktywnym wariantem jest parylene X, który w niektórych jednostkach zawiera grupę etynylową – C toCH przyłączoną do pierścienia fenylowego. Ten wariant, który nie zawiera żadnych pierwiastków innych niż wodór i węgiel, może być sieciowany ciepłem lub światłem UV i może reagować z solami miedzi lub srebra, tworząc odpowiednie kompleksy metaloorganiczne Cu-acetylek lub Ag-acetylek . Może również podlegać " chemii kliknięć " i może być stosowany jako klej , umożliwiając wiązanie parylen-parylen bez żadnych produktów ubocznych podczas przetwarzania. W przeciwieństwie do większości innych wariantów, parylen X jest amorficzny (niekrystaliczny).
Kolorowe paryleny
Możliwe jest przyłączenie chromoforu bezpośrednio do cząsteczki zasady [2.2]paracyklofanu, aby nadać parylenowi kolor.
Kopolimery parylenopodobne
Polimery i nanokompozytów (SiO 2 / Parylen C) parylenu zdeponowano w temperaturze bliskiej pokojowej poprzednio; a w przypadku komonomerów silnie wyciągających elektrony, parylen można stosować jako inicjator do inicjowania polimeryzacji, tak jak w przypadku N- fenylomaleimidu . Stosując nanokompozyty parylene C/SiO 2 , parylene C można wykorzystać jako warstwę protektorową do wytwarzania cienkich warstw nanoporowatej krzemionki o porowatości >90%.
Nieruchomości
Przejrzystość i krystaliczność
Cienkie folie i powłoki Parylenu są przezroczyste; jednak nie są one amorficzne z wyjątkiem alkilowanych parylenów. tj. parylene E. W wyniku tego, że powłoki są półkrystaliczne, rozpraszają światło. Parylen N i C mają niski stopień krystaliczności; jednakże parylene VT-4 i AF-4 są wysoce krystaliczne ~60% w stanie po osadzeniu (heksagonalna struktura krystaliczna) i dlatego generalnie nie są odpowiednie jako materiały optyczne.
Parylen C stanie się bardziej krystaliczny po podgrzaniu w podwyższonej temperaturze do temperatury topnienia 270 °C.
Parylen N ma jednoskośną strukturę krystaliczną w stanie po złożeniu i nie staje się wyraźnie bardziej krystaliczny, dopóki nie przejdzie krystalograficznej transformacji fazowej w ~220 °C do heksagonalnej, w którym to momencie staje się wysoce krystaliczny jak fluorowane paryleny. Może osiągnąć 80% krystaliczności w temperaturze wyżarzania do 400 °C, po czym ulega degradacji.
Mechaniczne i chemiczne
Paryleny są stosunkowo elastyczne (parylen N 0,5 GPa) z wyjątkiem usieciowanego parylenu X (1,0 GPa) i mają słabą odporność na utlenianie (~60-100 °C w zależności od kryteriów zniszczenia) i stabilność UV, z wyjątkiem parylenu AF-4. Jednak parylene AF-4 jest droższy ze względu na trzyetapową syntezę jego prekursora z niską wydajnością i słabą wydajnością osadzania. Ich stabilność UV jest tak słaba, że parylen nie może być wystawiony na regularne działanie promieni słonecznych bez żółknięcia.
Prawie wszystkie paryleny są nierozpuszczalne w temperaturze pokojowej, z wyjątkiem parylenów alkilowanych, z których jeden to parylen E i paryleny alkilowane-etynylowe. Ten brak rozpuszczalności utrudnił przeróbkę płytek obwodów drukowanych pokrytych parylenem.
Przepuszczalność
Jako bariera dla dyfuzji wilgoci, skuteczność halogenowanych powłok parylenowych skaluje się nieliniowo wraz z ich gęstością. Atomy halogenu, takie jak F, Cl i Br, dodają dużej gęstości powłoce, a zatem umożliwiają powłoce lepszą barierę dyfuzyjną; jednak, jeśli paryleny są stosowane jako bariera dyfuzyjna przeciwko wodzie, wówczas chemie apolarne, takie jak parylene E, są znacznie bardziej skuteczne. W przypadku barier przeciwwilgociowych trzy główne parametry materiału, które należy zoptymalizować, to: gęstość powłoki, polarność powłoki (najlepsza jest chemia olefin) oraz temperatura zeszklenia powyżej temperatury pokojowej, a najlepiej powyżej granicy użytkowania płytki obwodu drukowanego, urządzenia lub części. Pod tym względem parylene E jest najlepszym wyborem, chociaż ma niską gęstość w porównaniu na przykład z parylene C.
Proces powlekania
Powłoki parylenowe są na ogół nakładane przez osadzanie chemiczne z fazy gazowej w atmosferze monomeru para- ksylilenu lub jego pochodnej. Metoda ta ma jedną bardzo silną korzyść, a mianowicie nie generuje żadnych produktów ubocznych poza polimerem parylenowym, które musiałyby zostać usunięte z komory reakcyjnej i mogłyby zakłócać polimeryzację.
Powlekane części muszą być czyste, aby zapewnić dobrą przyczepność folii. Ponieważ monomer ulega dyfuzji, obszary, które nie mają być powlekane, muszą być hermetycznie zamknięte, bez szczelin, szczelin i innych otworów. Część musi być utrzymywana w stosunkowo wąskim oknie ciśnienia i temperatury.
Proces składa się z trzech etapów: wytworzenie gazowego monomeru, adsorpcja na powierzchni części oraz polimeryzacja zaadsorbowanego filmu.
Polimeryzacja
Polimeryzacja zaadsorbowanego monomeru p- ksylilenowego wymaga minimalnej temperatury progowej. W przypadku parylenu N jego temperatura progowa wynosi 40 °C.
P ksylilenodiamina pośrednia ma dwa kwantową mechaniczne stan benzoid (stan triplet) i stan quinoid (stan singlet). Stan tripletowy jest skutecznie inicjatorem, a stan singletowy jest skutecznie monomerem. Stan tryplet może być dezaktywowany, gdy styka się z metali lub tlenków metali przejściowych w tym Cu / CuO x . Wiele parylenów wykazuje tę selektywność opartą na kwantowej mechanicznej dezaktywacji stanu tripletowego, w tym parylen X.
Polimeryzacja może przebiegać różnymi drogami, różniącymi się przejściowym zakończeniem rosnących łańcuchów, takimi jak grupa rodnikowa – CH•
2lub ujemna grupa anionowa CH−
2:
Fizysorpcja
Monomer polimeryzuje dopiero po fizycznym zaadsorbowaniu ( fizysorpcji ) na powierzchni części. Proces ten ma odwrotną kinetykę Arrheniusa , co oznacza, że jest silniejszy w niższych temperaturach niż w wyższych. Istnieje krytyczna temperatura progowa, powyżej której praktycznie nie ma sorpcji fizycznej, a zatem nie ma osadzania. Im temperatura osadzania jest bliższa temperaturze progowej, tym słabsza fizysorpcja. Parylen C ma wyższą temperaturę progową, 90 °C, a zatem ma znacznie wyższą szybkość osadzania, większą niż 1 nm / s, jednocześnie dając dość jednorodne powłoki. W przeciwieństwie do tego temperatura progowa parylenu AF-4 jest bardzo zbliżona do temperatury pokojowej (30–35 °C), w wyniku czego jego wydajność osadzania jest słaba.
Ważną właściwością monomeru jest tak zwany „współczynnik przywierania”, który wyraża stopień, w jakim jest adsorbowany na polimerze. Niższy współczynnik skutkuje bardziej jednorodną grubością osadzania i bardziej dopasowaną powłoką.
Inną istotną właściwością procesu osadzania jest polaryzowalność, która określa, jak silnie monomer oddziałuje z powierzchnią. Osadzanie chlorowcowanych parylenów silnie koreluje z masą cząsteczkową monomeru. Wyjątkiem są warianty fluorowane: polaryzowalność parylenu AF-4 jest niska, co skutkuje nieefektywnym osadzaniem.
Generacja monomerów
Z cyklicznego dimeru
P monomerów ksylilenodiamina normalnie generowanych w trakcie procesu powlekania przez odparowanie cykliczny dimer [2.2] para - cyklofanu w stosunkowo niskiej temperaturze, a następnie rozłożenia pary w 450-700 ° C i ciśnienie 0,01-1,0 mm Hg . Ta metoda (proces Gorhama) daje 100% monomeru bez produktów ubocznych lub rozkładu monomeru.
Dimer można zsyntetyzować z p- ksylenu w kilku etapach obejmujących bromowanie , aminowanie i eliminację Hofmanna .
Tę samą metodę można zastosować do osadzania podstawionych parylenów. Na przykład parylen C można otrzymać z dimerycznego prekursora dichloro[2.2] para- cyklofanu , z tym wyjątkiem, że temperatura musi być dokładnie kontrolowana, ponieważ wiązanie chlor - aryl pęka w temperaturze 680 °C.
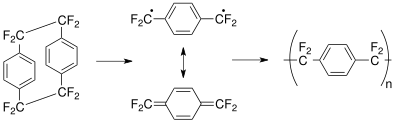
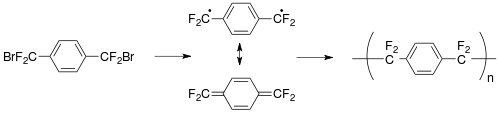
Standardowy proces Gorhama pokazano powyżej dla parylene AF-4. Dimer prekursora oktafluoro[2.2] para- cyklofanu może być sublimowany poniżej <100 °C i krakowany w temperaturze 700-750 °C, wyższej niż temperatura (680 °C) stosowana do krakowania niepodstawionego cyklofanu, ponieważ -CF 2- CF 2 - wiązanie jest silniejsze niż -CH 2 -CH 2 - wiązanie. Ten stabilizowany rezonansem związek pośredni jest transportowany do komory osadzania w temperaturze pokojowej, gdzie polimeryzacja zachodzi w warunkach niskiego ciśnienia (1-100 mTorr).
Z podstawionych p- ksylenów
Inną drogą generowania monomeru jest zastosowanie prekursora para- ksylenu z odpowiednim podstawnikiem na każdej grupie metylowej , którego eliminacja generuje para- ksylilen.
Wybór grupy opuszczającej może uwzględniać jej toksyczność (która wyklucza reakcje oparte na siarce i aminach), łatwość opuszczania prekursora oraz możliwą ingerencję w polimeryzację. Grupa opuszczająca może być albo uwięziona przed komorą osadzania, albo może być wysoce lotna, tak że nie kondensuje się w tej ostatniej.
Na przykład prekursor α,α'-dibromo-α,α,α',α'-tetrafluoro- para- ksylen (CF
2Br)
2(DO
6H
4) daje parylen AF-4 z eliminacją bromu .
Zaletą tego procesu jest niski koszt syntezy prekursora. Prekursor jest również cieczą i może być dostarczany standardowymi metodami opracowanymi w branży półprzewodników, takimi jak parownik, parownik z bełkotką lub regulator przepływu masy . Pierwotnie prekursor był po prostu krakowany termicznie, ale odpowiednie katalizatory obniżały temperaturę pirolizy, co skutkowało mniejszą pozostałością zwęglenia i lepszą powłoką. Przy obu formuje się brom atomowy wolnego rodnika jest wydzielany z każdego końca metyl, który może być przekształcony do bromowodoru HBr i usuwa się z monomerów przepływu. Potrzebne są specjalne środki ostrożności, ponieważ brom i HBr są toksyczne i korozyjne w stosunku do większości metali i stopów metali, a brom może uszkodzić o-ringi z vitonu .
Podobna synteza parylenu N wykorzystuje prekursor α,α'-dimetoksy- p- ksylen . Grupa metoksy H
3CO – jest grupą opuszczającą; podczas kondensacji w komorze osadzania nie zakłóca osadzania polimeru. Prekursor ten jest znacznie tańszy niż [2.2] para- cyklofan. Co więcej, będąc cieczą tuż powyżej temperatury pokojowej, prekursor ten może być dostarczany niezawodnie za pomocą masowego regulatora przepływu ; podczas gdy wytwarzanie i dostarczanie gazowego monomeru w procesie Gorhama jest trudne do zmierzenia i kontrolowania.
Ta sama chemia może generować parylen AM-2 może być generowany z prekursora α,α'-dimetylo-α,α'-dimetoksy- p- ksylenu.
Innym przykładem tego podejścia jest synteza parylenu AF-4 z α,α'-difenoksy-α,α,α',α'-tetrafluoro- para- ksylenu. W tym przypadku grupą opuszczającą jest fenoksy CH
5O – który może być skondensowany przed komorą osadzania.
Charakterystyka i zalety
Paryleny mogą nadawać powlekanym częściom kilka pożądanych właściwości. Wśród innych właściwości są
- Hydrofobowy , odporny chemicznie, w większości nieprzepuszczalny dla gazów (w tym pary wodnej) oraz cieczy nieorganicznych i organicznych (w tym mocnych kwasów i zasad ).
- Dobry izolator elektryczny o niskiej stałej dielektrycznej (średnia w płaszczyźnie i poza płaszczyzną: 2,67 parylene N i 2,5 parylene AF-4, SF, HT)
- Stabilny i akceptowany w tkankach biologicznych, zatwierdzony przez amerykańską FDA do różnych zastosowań medycznych.
- Gęsty i wolny od porów, dla grubości powyżej 1,4 nm
- Jednorodna i jednolicie gęsta, nawet w ubytkach.
- Odporny na utlenianie do 350 °C (AF-4, SF, HT)
- Niski współczynnik tarcia (AF-4, HT, SF)
Ponieważ proces powlekania odbywa się w temperaturze otoczenia w łagodnej próżni, można go nakładać nawet na przedmioty wrażliwe na temperaturę, takie jak suche próbki biologiczne. Niska temperatura skutkuje również niskimi naprężeniami wewnętrznymi w cienkiej warstwie. Co więcej, jedynym gazem w komorze osadzania jest monomer, bez żadnych rozpuszczalników, katalizatorów lub produktów ubocznych, które mogłyby zaatakować obiekt.
Parylene AF-4 i VT-4 są zarówno fluorowane, a przez to bardzo drogie w porównaniu z parylenem N i C, co poważnie ograniczyło ich zastosowanie komercyjne, z wyjątkiem zastosowań niszowych.
Aplikacje
Parylene C i w mniejszym stopniu AF-4, SF, HT (wszystkie te same polimery) są używane do powlekania płytek obwodów drukowanych (PCB) i urządzeń medycznych . Istnieje wiele innych zastosowań, ponieważ parylen jest doskonałą barierą dla wilgoci. Jest to najbardziej bioakceptowana powłoka do stentów, defibrylatorów, rozruszników serca i innych urządzeń na stałe wszczepianych w ciało.
Warstwy molekularne
Klasyczna chemia warstw molekularnych to samoorganizujące się monowarstwy (SAM). SAM to długołańcuchowe łańcuchy alkilowe, które oddziałują z powierzchniami w oparciu o oddziaływanie siarka-metal (alkilotiolany) lub reakcję typu zol-żel z hydroksylowaną powierzchnią tlenku (trichlorosililoalkile lub trialkoksyalkile). Jednak o ile powierzchnia złota lub tlenku nie zostanie starannie obrobiona, a łańcuch alkilowy jest długi, te SAM tworzą nieuporządkowane monowarstwy, które nie są dobrze upakowane. Ten brak opakowania powoduje problemy, na przykład ze stacją w urządzeniach MEMS .
Obserwacja, że paryleny mogą tworzyć uporządkowane warstwy molekularne (ML) pojawiła się wraz z pomiarami kąta zwilżania , gdzie ML grubsze niż 10 Å miały równowagowy kąt zwilżania 80 stopni (tak samo jak masowy parylen N), ale te cieńsze miały zmniejszony kąt zwilżania. Zostało to również potwierdzone pomiarami elektrycznymi (pomiary napięcia wstępnego i temperaturowego) przy użyciu kondensatorów metal-izolator-półprzewodnik (MISCAP). W skrócie, paryleny N i AF-4 (te paryleny bez grup funkcyjnych) są wolne od otworków przy ~14 Å. Wynika to z tego, że parylenowe jednostki powtarzalne posiadają pierścień fenylowy i ze względu na wysoką elektronową polaryzowalność pierścienia fenylowego sąsiednie jednostki powtarzalne porządkują się w płaszczyźnie XY. W wyniku tej interakcji parylenowe MLs są niezależne od powierzchni, z wyjątkiem metali przejściowych, które dezaktywują stan tripletowy (benzoidowy), a zatem paryleny nie mogą zostać zainicjowane. To odkrycie parylenów jako warstw molekularnych jest bardzo skuteczne w zastosowaniach przemysłowych ze względu na solidność procesu i to, że ML osadza się w temperaturze pokojowej. W ten sposób paryleny można stosować jako bariery dyfuzyjne i do zmniejszania polaryzowalności powierzchni (dezaktywacja powierzchni tlenkowych). Łącząc właściwości reaktywnych parylenów z obserwacją, że mogą one tworzyć gęste, pozbawione otworków warstwy molekularne, parylen X został wykorzystany jako warstwa pośrednia do sekwencjonowania genomu.
Jedno zastrzeżenie dotyczące parylenów warstwy molekularnej, a mianowicie są one osadzane jako oligomery, a nie wysokopolimerowe. W rezultacie potrzebne jest wyżarzanie próżniowe w celu przekształcenia oligomerów w wysokopolimerowy. W przypadku parylenu N temperatura ta wynosi 250 °C, podczas gdy dla parylene AF-4 wynosi 300 °C.
Typowe aplikacje
Folie Parylenowe były wykorzystywane w różnych zastosowaniach, m.in
- Powłoka hydrofobowa (bariery przeciwwilgociowe, np. do węży biomedycznych)
- Warstwy barierowe (np. dla filtrów, membran, zaworów)
- Elektronika mikrofalowa (np. ochrona podłoży dielektrycznych PTFE przed zanieczyszczeniem olejem)
- Wszczepialne urządzenia medyczne
- Czujniki w trudnych warunkach (np. samochodowe czujniki paliwa/powietrza)
- Elektronika do podróży kosmicznych i obrony
- Ochrona antykorozyjna powierzchni metalowych
- Wzmocnienie mikrostruktur
- Ochrona plastiku, gumy itp. przed szkodliwymi warunkami środowiskowymi
- Redukcja tarcia np. przy prowadzeniu cewników, igieł do akupunktury i systemów mikroelektromechanicznych .
Zobacz też
Bibliografia
- ^ a b c Jeffrey B. Fortin; Toh-Ming Lu (2003). Polimeryzacja z parowaniem chemicznym: wzrost i właściwości cienkich warstw parylenu . Skoczek. s. 4–7. Numer ISBN 978-1-4020-7688-6.
- ^ a b Mattox, DM Podstawy technologii powlekania próżniowego Zarchiwizowane 2009-10-07 w Wayback Machine , Springer, 2003 ISBN 978-3-540-20410-7 Książki Google
- ^ Historia powłok SCS zarchiwizowana 2012-01-12 w Wayback Machine . Scscoatings.com. Pobrano 2012-06-04.
- ^ a b „Parylene: The Truly Conformal Thin Film Coating” (PDF) . Wzmocnione rozwiązania plazmowe . PRS.
- ^ B W.F. Gorham (1966). „Nowa, ogólna metoda syntetycznego przygotowania liniowych poli-p-ksylilenów”. Journal of Polymer Science Część A-1: Chemia polimerów . 4 (12): 3027–3039. Kod bib : 1966JPoSA...4.3027G . doi : 10.1002/pol.1966.150041209 .
- ^ B J. J. Senkevich; CJ Mitchell; A. Widżajaraghawan; EV Barnata; JF McDonald; T.-M. Lu (2002). „Unikalna struktura / właściwości osadzonego pary chemicznej Parylen E”. Journal of Vacuum Science and Technology A . 20 (4): 1445-9. Kod bib : 2002JVSTA..20.1445S . doi : 10.1116/1.1487870 .
- ^ JF Gaynor; JJ Sienkiewicza; SB Desu (1996). „Nowa metoda wytwarzania cienkich folii polimerowych o wysokiej wydajności przez polimeryzację z parą chemiczną”. J. Mater. Res . 11 (7): 1842–50. Kod bib : 1996JMatR..11.1842G . doi : 10.1557/JMR.1996.0233 .
- ^ JJ Senkiewicza; SB Desu (1999). „W pobliżu temperatury pokojowej chemiczne osadzanie z fazy gazowej poli(chloro- p- ksylilenu)/SiO 2 nanokompozyty”. Chemia materiałów . 11 (7): 1814–21. doi : 10.1021/cm990042q .
- ^ JJ Senkiewicz (1999). „CVD nanoporowatej krzemionki”. Osadzanie chemiczne z par . 5 (6): 257–60. doi : 10.1002/(SICI)1521-3862(199912)5:6<257::AID-CVDE257>3.0.CO;2-J .
- ^ C. Chiang, AS Mack, C. Pan, Y.-L. Ling, DB Fraser Mat. Res. Soc. Symp. Proc. obj. 381, 123 (1995).
- ^ JJ Senkiewicza; BW Woods; JJ McMahona; P.-I Wang (2007). „Właściwości termomechaniczne Parylen X, polimeru sieciującego się polimeru chemicznego w temperaturze pokojowej”. Osadzanie chemiczne z par . 13 (1): 55–59. doi : 10.1002/cvde.200606541 .
- ^ JB Fortin i TM Lu (2001). „Promieniowanie ultrafioletowe wywołane degradacją poli-para-ksylilenu (parylenu) cienkich warstw”. Cienkie folie stałe . 397 (1–2): 223–228. Kod bib : 2001TSF...397..223F . doi : 10.1016/S0040-6090(01)01355-4 .
- ^ Senkiewicz, Jay J. (2014). „Tert-butyletynylo-parylen i fenyloetynylo-parylen”. Osadzanie chemiczne z par . 20 (1–2–3): 39–43. doi : 10.1002/cvde.201307071 .
- ^ Horn, Sean „Proces osadzania parylenu: wstępne osadzanie” https://www.paryleneconformalcoating.com/#TheParyleneDepositionProcess
- ^ KM Vaeth i KF Jensen (1999). „Selektywny wzrost poli(p-fenylenu winylenu) przygotowanego przez chemiczne osadzanie z fazy gazowej”. Zaawansowane materiały . 11 (10): 814–820. doi : 10.1002/(SICI)1521-4095(199907)11:10<814::AID-ADMA814>3.0.CO;2-Z .
- ^ JJ Senkiewicz; CJ Wieganda; G.-R. Jang; T.-M. Lu (2004). „Selektywne osadzanie ultra-cienkich folii poli(p-ksylilenowych) na dielektrykach w porównaniu z powierzchniami miedzi”. Osadzanie chemiczne z par . 10 (5): 247–9. doi : 10.1002/cvde.200304179 .
- ^ a b "GlobalTop Technology | Tajwan | Proszek z azotku aluminium" .
- ^ JB Fortin i TM Lu (2000). „Badanie spektrometrii masowej podczas naparowywania cienkich warstw poli-para-ksylilenu”. Journal of Vacuum Science and Technology A . 18 (5): 2459. Kod bib : 2000JVSTA..18.2459F . doi : 10.1116/1.1289773 .
- ^ HJ Rzesza; DJ Cram (1969). „Makro pierścienie XXXVI. Rozszerzenie pierścienia, racemizacja i przekształcenia izomerów w układzie [2.2] paracyklofanu poprzez dwurodnik pośredni”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 91 (13): 3517–3526. doi : 10.1021/ja01041a016 .
- ^ P. Kramera; AK Sharma; EE Henneckego; H. Yasuda (2003). „Polimeryzacja pochodnych para-ksylilenu (polimeryzacja parylenu). I. Kinetyka osadzania dla parylenu N i parylenu C”. Journal of Polymer Science: Polymer Chemistry Edition . 22 (2): 475–491. Kod bib : 1984JPoSA..22..475K . doi : 10.1002/pol.1984.170220218 .
- ^ HE Winberg i FS Fawcett (1973). „Tricyklo[8.2.2.24,7]heksadeka-4,6,10,12,13,15-heksaen” . Syntezy organiczne .
- ^ B J.J. Senkevich (2011): „CVD poli(α,α'-dimetylo- p- ksylilenu i poli(α,α,α',α'-tetrametylo- p- ksylilenu)-ko-poli( p- ksylilenu) z alkoholanu Prekursory I: Właściwości optyczne i stabilność termiczna. Chemiczne osadzanie z fazy gazowej, tom 17, strony 235-240.
- ^ PK Wu; G.-R. Jang; L. Ty; D. Mathura; A. Cocoziello; C.-I. Lang; JA Moore'a; T.-M. Lu; H. Bakru (1997). „Osadzanie parylenu o wysokiej czystości F przy użyciu niskociśnieniowego osadzania chemicznego z fazy gazowej w niskiej temperaturze”. Czasopismo Materiałów Elektronicznych . 26 (8): 949-953. Kod Bibcode : 1997JEMat..26..949W . doi : 10.1007/s11664-997-0280-8 . S2CID 94987047 .
-
^ Pebalk, AV; Kardash, IE; Kozłowa, NV; Zajcewa, EL; Kozłow, Yu. ZA.; Prawednikow, AN (1980). Vysokomolekulyarnye Soedineniya, Seriya A . 22 (5): 972–6. Brakujące lub puste
|title=( pomoc ) - ^ Lee, Chung J.; Wang, Hui; Foggiato, Giovanni Antonio, patent USA 6 140 456 , data wydania: 31 października 2000.
- ^ Lee, Chung J., Patent US 6,703,462 , Data wydania: 9 marca 2004 r.
- ^ Senkiewicz, Jay J. (2011). „Droga prekursora cieczy bezhalogenowej do Parylenu”. Osadzanie chemiczne z par . 17 (4–6): 76–79. doi : 10.1002/cvde.201104304 .
- ^ DM Dobkin, S. Mokhtari, M. Schmidt, A. Pant, L. Robinson, Mechanizmy osadzania SiO2 z TEOS i pokrewnych związków krzemoorganicznych i ozonu" J. Electrochem. Soc. 142 (7), 2332-40 (1995) ).
- ^ Senkiewicz, Jay J. (2013). „Parylen AF-4 poprzez pułapkowanie fenoksy opuszczającej grupy”. Osadzanie chemiczne z par . 19 (10-11-12): 327-331. doi : 10.1002/cvde.201304321 .
- ^ JJ Senkiewicz; SB Desu (1999). „Badania składowe temperatury bliskiej temperaturze pokojowej CVD nanokompozytów poli(chloro-p-ksylilen)/SiO 2 ”. Chemia Materiałów . 11 (5): 1814. Kod Bib : 2000ApPhA..70..541S . doi : 10.1007/s003390051076 . S2CID 96072554 .
- ^ B c J. J. Senkevich i P.-I. Wang (2009). „Chemia warstw molekularnych przez Parylenes”. Osadzanie chemiczne z par . 15 (4–6): 91–94. doi : 10.1002/cvde.200804266 .
- ^ James A. Schwarz; Cristian I. Contescu; Karol Putyera (2004). Encyklopedia Dekkera z nanonauki i nanotechnologii, tom 1 . CRC Prasa. str. 263. Numer ISBN 978-0-8247-5047-3.
- ^ Laibinis, Paweł E.; Whitesides, George M.; Allara, David L.; Tao, Yu Tai; Parikh, Atul N.; Nuzzo, Ralph G. (1991). „Porównanie struktury i właściwości zwilżających samoorganizujących się monowarstw n-alkanotioli na powierzchniach metali monet, miedzi, srebra i złota”. Czasopismo Amerykańskiego Towarzystwa Chemicznego . 113 (19): 7152. doi : 10.1021/ja00019a011 .
- ^ Wasserman, Stephen R.; Tao, Yu Tai; Whitesides, George M. (1989). „Struktura i reaktywność monowarstw alkilosiloksanowych powstałych w wyniku reakcji alkilotrichlorosilanów na podłożach krzemowych”. Langmuira . 5 (4): 1074. doi : 10.1021/la00088a035 .
- ^ Fadeev, Aleksander Y.; McCarthy, Thomas J. (2000). „Samoorganizacja nie jest jedyną możliwą reakcją między alkilotrichlorosilanami a powierzchniami: Monomolekularne i oligomeryczne kowalencyjnie przyłączone warstwy dichloro- i trichloroalkilosilanów na krzemie”. Langmuira . 16 (18): 7268. doi : 10.1021/la000471z .
- ^ Senkiewicz, Jay J.; Mitchell, Christopher J.; Yang, GR; Lu, T.-M. (2002). „Chemia powierzchni merkaptanu i wzrost krótkołańcuchowych warstw molekularnych alkoksysilanu pirydyny”. Langmuira . 18 (5): 1587. doi : 10.1021/la010970f .
- ^ Z. Yapu (2003). „Sticction i anty-styk w MEMS i NEMS”. Acta Mechanica Sinica . 19 (1): 1. Kod bib : 2003AcMSn..19....1Z . doi : 10.1007/BF02487448 . S2CID 110540114 .
- ^ Senkiewicz, Jay J.; Wang, Pei-I.; Wiegand, Chris J.; Lu, T.-M. (2004). „Stabilność polaryzacji temperaturowej ultracienkich dielektryków PETEOS pokrytych parylenem: Wpływ tlenu powierzchniowego na dyfuzję jonów miedzi”. Litery Fizyki Stosowanej . 84 (14): 2617. Kod Bib : 2004ApPhL..84.2617S . doi : 10.1063/1.1691488 .