ftalocyjanina - Phthalocyanine

|
|

|
|
| Nazwy | |
|---|---|
| Inne nazwy | |
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.008.527 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 32 H 18 N 8 | |
| Masa cząsteczkowa | 514,552 g·mol -1 |
| Zagrożenia | |
| Piktogramy GHS |

|
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
ftalocyjanina ( H
2PC ) jest duże, aromatyczne , makrocykliczny , organiczny związek o wzorze (C
8h
4n
2)
4h
2 i ma teoretyczne lub specjalistyczne zainteresowanie barwnikami chemicznymi i fotoelektryką.
Składa się z czterech jednostek izoindolowych połączonych pierścieniem atomów azotu. (C
8h
4n
2)
4h
2= H
2Pc ma dwuwymiarową geometrię i układ pierścieni składający się z 18 elektronów π . Szeroka delokalizacja elektronów π zapewnia cząsteczce użyteczne właściwości, co nadaje się do zastosowań w barwnikach i pigmentach. kompleksy metali pochodzące z Pc2-
, sprzężona zasada H
2Pc , są cenne w katalizie , organicznych ogniwach słonecznych i terapii fotodynamicznej .
Nieruchomości
Kompleksy ftalocyjaniny i metali pochodnych (MPc) mają tendencję do agregacji, a zatem mają niską rozpuszczalność w zwykłych rozpuszczalnikach. Benzen w temperaturze 40 °C rozpuszcza mniej niż miligram H
2Pc lub CuPc na litr. h
2Pc i CuPc łatwo rozpuszczają się w kwasie siarkowym dzięki protonowaniu atomów azotu mostkujących pierścienie pirolu . Wiele związków ftalocyjaniny jest termicznie bardzo stabilnych i nie topi się, ale można je sublimować . CuPc sublimuje w temperaturze powyżej 500 °C w gazach obojętnych ( azot , CO
2). Podstawione kompleksy ftalocyjaniny często mają znacznie wyższą rozpuszczalność. Są mniej stabilne termicznie i często nie można ich sublimować. Niepodstawione ftalocyjaniny silnie pochłaniają światło w zakresie od 600 do 700 nm , dlatego są to materiały niebieskie lub zielone. Substytucja może przesunąć absorpcję w kierunku dłuższych fal, zmieniając kolor z czystego niebieskiego na zielony na bezbarwny (gdy absorpcja jest w bliskiej podczerwieni ).
Istnieje wiele pochodnych macierzystej ftalocyjaniny, w których albo atomy węgla makrocyklu są wymienione na atomy azotu, albo obwodowe atomy wodoru są podstawione grupami funkcyjnymi, takimi jak halogeny , grupy hydroksylowe , aminowe , alkilowe , arylowe , tiolowe , alkoksylowe i nitrozylowe . Modyfikacje te pozwalają na dostrojenie właściwości elektrochemicznych cząsteczki, takich jak długość fali absorpcji i emisji oraz przewodnictwo.
Historia
W 1907 doniesiono o niezidentyfikowanym niebieskim związku, obecnie znanym jako ftalocyjanina. W 1927 roku, naukowcy Swiss nieoczekiwanie odkryto ftalocyjaniny miedzi, naftalocyjaninowe i miedzi octamethylphthalocyanine w próbie konwersji o -dibromobenzene do ftalonitrylu . Zwrócili uwagę na ogromną stabilność tych kompleksów, ale nie scharakteryzowali ich dalej. W tym samym roku w Scottish Dyes of Grangemouth w Szkocji (później ICI ) odkryto ftalocyjaninę żelaza . Dopiero w 1934 roku Sir Patrick Linstead scharakteryzował chemiczne i strukturalne właściwości ftalocyjaniny żelaza.
Synteza
Ftalocyjanina powstaje w wyniku cyklotetrameryzacji różnych pochodnych kwasu ftalowego, w tym ftalonitrylu , diiminoizoindolu , bezwodnika ftalowego i ftalimidów . Alternatywnie, ogrzewanie bezwodnika ftalowego w obecności mocznika daje H
2szt . Przy użyciu takich metod w 1985 roku wyprodukowano około 57 000 ton (63 000 ton imperialnych) różnych ftalocyjaniny.
Częściej MPc jest syntetyzowany, a nie H
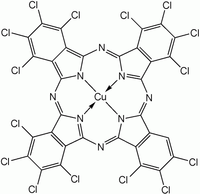
2Pc ze względu na większe zainteresowanie badawcze tym pierwszym. W celu przygotowania tych kompleksów syntezę ftalocyjaniny prowadzi się w obecności soli metali. Na poniższym rysunku przedstawiono dwie ftalocyjaniny miedzi.
Pochodne fluorowcowane i sulfonowane ftalocyjaniny miedzi są ważne z handlowego punktu widzenia jako barwniki. Takie związki wytwarza się przez traktowanie CuPc z chloru , bromu lub oleum .
Aplikacje
Przy początkowym odkryciu PC jego zastosowania ograniczały się głównie do barwników i pigmentów. Modyfikacja podstawników przyłączonych do pierścieni obwodowych pozwala na dostrojenie właściwości absorpcji i emisji Pc w celu uzyskania różnie zabarwionych barwników i pigmentów. Od tego czasu przeprowadzono znaczące badania nad H 2 Pc i MPc, które zaowocowały szerokim zakresem zastosowań w dziedzinach takich jak fotowoltaika , terapia fotodynamiczna , konstrukcja nanocząstek i kataliza. Właściwości elektrochemiczne MPc czynią je skutecznymi donorami i -akceptorami elektronów. W rezultacie opracowano organiczne ogniwa słoneczne na bazie MPc o sprawności konwersji energii wynoszącej 5% lub mniej. Ponadto MPcs były stosowane jako katalizatory do utleniania metanu, fenoli, alkoholi, polisacharydów i olefin; MPcs można również stosować do katalizowania tworzenia wiązań C–C i różnych reakcji redukcji. Ftalocyjaniny krzemu i cynku zostały opracowane jako fotouczulacze do nieinwazyjnego leczenia raka. Różne MPcs wykazały również zdolność do tworzenia nanostruktur, które mają potencjalne zastosowania w elektronice i bioczujnikach . Ftalocyjanina jest również stosowana na niektórych płytach DVD do nagrywania.
Toksyczność i zagrożenia
Nie zgłoszono dowodów na ostrą toksyczność lub rakotwórczość związków ftalocyjaniny. W LD 50 (szczury, doustne) jest 10 g / kg.
Związki pokrewne
Ftalocyjaniny są strukturalnie spokrewnione z innymi makrocyklami tetrapirolowymi, w tym porfirynami i porfirazynami . Składają się z czterech podjednostek podobnych do pirolu , połączonych w 16-członowy pierścień wewnętrzny złożony z naprzemiennych atomów węgla i azotu. Strukturalnie większe analogi obejmują naftalocyjaniny . Pierścienie podobne do pirolu w obrębie H
2Pc są blisko spokrewnione z izoindolem . Zarówno porfiryny, jak i ftalocyjaniny działają jako płaskie tetrakleszczowe ligandy dianionowe, które wiążą metale przez cztery wystające do wewnątrz centra azotu. Takie kompleksy są formalnie pochodnymi Pc 2- , tym koniugat podstawy z H
2szt .
Przypisy
Bibliografia
Zewnętrzne linki
- „Towarzystwo Porfiryn i ftalocyjaniny” . spp-jpp.org .
- Wiki zał. (2006-03-21) autorstwa Henryka Rzepy. Sir Patrick Linstead: Ftalocyjaniny . Wydział Chemii. ChemWiki (wideo). Wielka Brytania: Imperial College .
- „Dziennik Porfiryn i ftalocyjaniny” . worldscinet.com/jpp/ .
- „Odkrycie ICI Grangemouth” (wideo) – via colorantshistory.org.