Kinaza rybosomalna s6 - Ribosomal s6 kinase
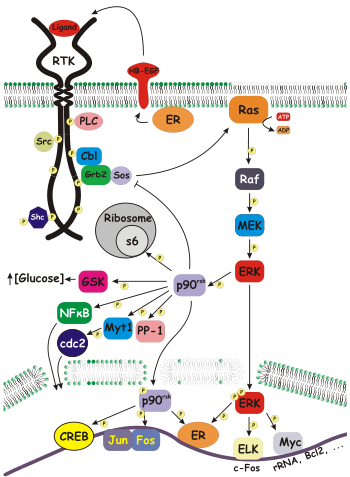
W biologii molekularnej , rybosomalnego S6 kinazę ( RSK ) to rodzina kinaz białkowych biorących udział w transdukcji sygnału . Istnieją dwie podrodziny rsk, p90 rsk , znane również jako kinaza białkowa aktywowana przez MAPK-1 (MAPKAP-K1) i p70 rsk , znana również jako kinaza S6-H1 lub po prostu kinaza S6 . Istnieją trzy warianty p90 rsk u ludzi, rsk 1-3. Rsks są kinazami serynowo-treoninowymi i są aktywowane przez szlak MAPK/ERK . Istnieją dwa znane ssacze homologi kinazy S6: S6K1 i S6K2 .
Podłoża
Zarówno p90, jak i p70 Rsk fosforylują białko rybosomalne s6 , część maszynerii translacyjnej, ale zidentyfikowano kilka innych substratów, w tym inne białka rybosomalne. Substraty cytozolowe p90 rsk obejmują fosfatazę białkową 1 ; kinaza syntazy glikogenu 3 (GSK3); L1 CAM , cząsteczka adhezyjna komórek nerwowych; Syn Sevenless , czynnik wymiany Ras ; oraz Myt1 , inhibitor cdc2 .
Fosforylacja RSK SOS1 ( Son of Sevenless ) w Serines 1134 i 1161 tworzy miejsce dokowania 14-3-3 . To oddziaływanie fosfo SOS1 i 14-3-3 negatywnie reguluje szlak Ras-MAPK .
p90 rsk reguluje również czynniki transkrypcyjne, w tym białko wiążące element odpowiedzi cAMP (CREB); receptor estrogenowy -α (ERα); IκBα / NF-κB ; i c-Fos .
Genomika
p90 Rsk-2 znajduje się w Xp22.2 i zawiera 22 egzony . Mutacje w tym genie powiązano z zespołem Coffina-Lowry'ego , chorobą charakteryzującą się ciężkim opóźnieniem psychoruchowym i innymi nieprawidłowościami rozwojowymi.
p90 Rsk-3 znajduje się w 6q27 .
Proteomika
Główną cechą odróżniającą p90 rsk i p70 rsk jest to, że rodzina 90 kDa zawiera dwie nieidentyczne domeny kinazy, podczas gdy rodzina 70 kDa zawiera tylko jedną domenę kinazy.
Historia badań
Rsk został po raz pierwszy zidentyfikowany w jajach Xenopus laevis przez Eriksona i Mallera w 1985 roku.
Bibliografia
- ^ B Frodin, m; Gammeltoft, S (maj 1999). „Rola i regulacja 90 kDa rybosomalnej kinazy S6 (RSK) w transdukcji sygnału”. Mol. Komórka. Endokrynol . 151 (1–2): 65–77. doi : 10.1016/S0303-7207(99)00061-1 . PMID 10411321 . S2CID 42582996 .
- ^ Saha, M; Carriere, A; Cheerathodi, M; Zhang, X; Lavoie, G; Pośpiech, J; Roux, PP; Ballif, licencjat (2012). „Fosforylacja Rsk SOS1 ujemnie reguluje aktywację MAPK” . Czasopismo Biochemiczne . 447 (1): 159-66. doi : 10.1042/BJ20120938 . PMC 4198020 . PMID 22827337 .
- ^ GenBank , Entrez Gene
- ^ Online Mendlowskie dziedziczenie w człowieku (OMIM): 300075
- ^ Zhao, Y; Bjørbaek, C; Weremowicz S; Morton, CC; Moller, DE (1993). „RSK3 koduje nową izoformę pp90rsk z unikalną sekwencją N-końcową: funkcja kinazy stymulowana czynnikiem wzrostu i translokacja jądrowa” . Mol Komórkowy Biol . 15 (8): 4353–4363. doi : 10.1128/MCB.15.8.4353 . PMC 230675 . PMID 7623830 .
- ^ Na podstawie ryciny 2 i 5 w Frödin i Gammeltoft, 1999.
- ^ Erikson, Eleonora; Maller, James L. (1985). „Kinaza białkowa z jaj Xenopus specyficzna dla białka rybosomalnego S6” . PNAS . 82 (3): 742-746. Kod Bibcode : 1985PNAS...82..742E . doi : 10.1073/pnas.82.3.742 . PMC 397122 . PMID 3856226 .
Zewnętrzne linki
- Rybosomalny+Białko+S6+Kinazy,+90-kDa w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- Rybosomal + Białko + S6 + Kinazy, + 70-kDa w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)