Spektynomycyna - Spectinomycin
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Trobicin |
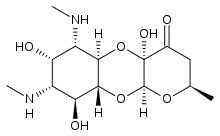
| Inne nazwy | (2 R , 4a R 5a R , 6 S , 7 S , 8 R 9 S , 9a R , 10a S ) -4a, 7,9-trihydroksy-2-metylo-6,8- bis (metyloamino) dekahydro -4 H -pirano [2,3- b ] [1,4] benzodioksyn-4-on |
| AHFS / Drugs.com | Monografia |
| Drogi administracji |
JESTEM |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CZEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.015.374 |
| Dane chemiczne i fizyczne | |
| Formuła | C 14 H 24 N 2 O 7 |
| Masa cząsteczkowa | 332.353 g·mol -1 |
| Model 3D ( JSmol ) | |
| Temperatura topnienia | 184 do 194 °C (363 do 381 °F) |
| |
| |
|
| |
Spektynomycyna , sprzedawana między innymi pod nazwą handlową Trobicin , jest antybiotykiem przydatnym w leczeniu infekcji rzeżączki . Podaje się go we wstrzyknięciu do mięśnia.
Częste działania niepożądane to ból w miejscu wstrzyknięcia, wysypka, nudności, gorączka i problemy ze snem. Czasami mogą wystąpić ciężkie reakcje alergiczne . Ogólnie jest bezpieczny w użyciu w czasie ciąży. Może być stosowany przez osoby uczulone na penicylinę lub cefalosporyny . Należy do klasy leków aminocyklitolowych i działa poprzez zatrzymanie wytwarzania białka przez niektóre bakterie.
Spektynomycyna została odkryta w 1961 roku. Znajduje się na Liście Leków Podstawowych Światowej Organizacji Zdrowia . Nie jest dostępny w Stanach Zjednoczonych do użytku u ludzi. Wytwarzany jest z bakterii Streptomyces spectabilis .
Zastosowania medyczne
Jest podawany we wstrzyknięciu domięśniowym w leczeniu rzeżączki , zwłaszcza u pacjentów uczulonych na penicyliny .
Ten antybiotyk nie jest już dostępny w Stanach Zjednoczonych do stosowania u ludzi, ale nadal jest dostępny do użytku weterynaryjnego.
Skutki uboczne
Efekty uboczne to swędzenie , dreszcze , ból brzucha i czerwona wysypka .
Mechanizm akcji
Spektynomycynę wiąże się z 30S podjednostki bakteryjnego rybosomu syntezy białka i przerwań. Jedna forma oporności pojawiła się w rybosomalnym RNA 16S u Pasteurella multocida .
Mechanizm biosyntetyczny
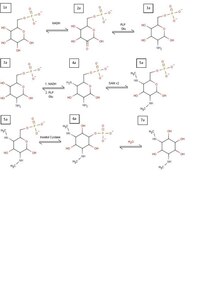
Biosynteza spektynomycyny zaczyna się podobnie jak w przypadku wszystkich aminoglikozydów, od powstania pierścienia inozytolowego . Różnica polega na początkowej modyfikacji, która tworzy pierścień inozytolowy spektynomycyny. Proces rozpoczyna się od glukozo-6-fosforanu (1a), który jest utleniany przez NAD +, tworząc keton w C2 (2a). Keton ten jest następnie formowany w pierwszorzędową grupę aminową przez fosforan pirydoksalu (PLP) i transaminację glutaminy (3a). Proces ten powtarza się ponownie w C4 z wytworzeniem drugiej pierwszorzędowej aminy (4a). Gdy te dwie aminy są obecne, pierścień glukozy jest gotowy do metylacji przez dwie cząsteczki S-adenozylometioniny (5a). Dzięki tej metylacji pierścień glukozowy jest w końcu gotowy do przekształcenia w pierścień inozytolowy przez cyklazę inozytolową (6a). Można go następnie zhydrolizować, aby pozbyć się grupy fosforanowej, dzięki czemu pierścień inozytolowy jest niezbędny dla spektynomycyny (7a).
Podczas gdy to wszystko się dzieje, zachodzi alternatywna ścieżka tworzenia cukrowej grupy funkcyjnej z podobnego produktu wyjściowego. W tym szlaku jako produkt wyjściowy (1b) stosuje się glukozo-1-fosforan . Jest on przekształcany w TDP-glukozę przez syntazę TDP (2b). Glukoza TDP następnie usuwa hydroksyl z C6 przez enzym hydratazę (3b), który jest następnie redukowany przez NADH w C4 tworząc nowy produkt (4b). W obecności tego ketonu, PLP i glutamina mogą wejść, aby przekształcić go w pierwszorzędową aminę (5b), którą można następnie usunąć przez deaminazę (6b). Tej konwersji do 6b towarzyszy również podwójna redukcja w C4 i C3 przez dwie kolejne cząsteczki NADH, dając produkt końcowy niezbędny do utworzenia aminoglikozydu. Dzięki temu produkty 7a i 6b mogą się łączyć, usuwając grupę funkcyjną TDP i łącząc się z cząsteczką cukru, tworząc aminoglikozydową spektynomycynę.
Natura
Należy do klasy aminocyklitoli , blisko spokrewnionych z aminoglikozydami . Spektynomycyna jest przemysłowo wytwarzana przez fermentację bakterii Streptomyces spectabilis . Spektynomycyna jest produkowana w przyrodzie przez wiele organizmów, w tym przez sinice i różne gatunki roślin. Jest obecny w genomie lub plastomie wielu plastydów jako operon spc , który zwykle ma długość od 2 do 10 genów. Różnica w wielkości może wynikać z eliminacji przestarzałych genów lub przejęcia ich funkcji przez geny jądrowe. Spektynomycyna jest produkowana głównie przez organizmy jako mechanizm obronny przed drapieżnikami.
Historia
Spektynomycyna została odkryta w 1961 roku. Zakłócenie dostaw nastąpiło w 2001 roku.
Bibliografia
Zewnętrzne linki
- „Spektynomycyna” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.