Wemurafenib - Vemurafenib
 | |
 | |
| Dane kliniczne | |
|---|---|
| Wymowa | / ˌ V ɛ m ə R Ć f ə n ɪ b / VEM -ə- RAF -ə piszącej |
| Nazwy handlowe | Zelboraf |
| Inne nazwy | PLX4032, RG7204, RO5185426 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a612009 |
| Dane licencyjne | |
Kategoria ciąży |
|
| Drogi administracji |
Doustnie ( tabletki ) |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Ligand PDB | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
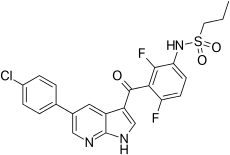
| Formuła | C 23 H 18 Cl F 2 N 3 O 3 S |
| Masa cząsteczkowa | 489,92 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
| (zweryfikować) | |
| wemurafenib | |
|---|---|
| Mechanizm narkotykowy | |
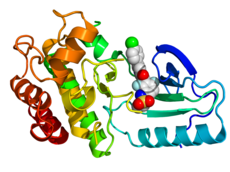
Struktura krystalograficzna B-Raf (kolor tęczowy, N-koniec = niebieski, C-koniec = czerwony) skompleksowany z wemurafenibem (kulki, węgiel = biały, tlen = czerwony, azot = niebieski, chlor = zielony, fluor = cyjan, siarka = żółty).
| |
| Zastosowanie terapeutyczne | czerniak |
| Cel biologiczny | BRAF |
| Mechanizm akcji | inhibitor kinazy białkowej |
| Linki zewnętrzne | |
| Kod ATC | L01 XE15 |
| Identyfikator ligandu PDB | 032: PDBe , RCSB PDB |
| LIGPLOT | 3og7 |
Vemurafenib ( INN , sprzedawany jako Zelboraf ) jest inhibitorem enzymu B-Raf opracowanego przez Plexxikon (obecnie część Daiichi-Sankyo) i Genentech do leczenia czerniaka w późnym stadium . Nazwa "vemurafenib" pochodzi z V 600 E il cyjna B RAF w H ib Rozbiórka.
Zatwierdzenia
Vemurafenib otrzymał zgodę FDA na leczenie czerniaka w późnym stadium 17 sierpnia 2011 r., co czyni go pierwszym lekiem zaprojektowanym z wykorzystaniem fragmentarycznego odkrycia ołowiu w celu uzyskania zatwierdzenia regulacyjnego.
Vemurafenib został później zatwierdzony przez Health Canada w dniu 15 lutego 2012 r.
20 lutego 2012 r. Komisja Europejska zatwierdziła wemurafenib jako monoterapię w leczeniu dorosłych pacjentów z nieoperacyjnym lub przerzutowym czerniakiem z mutacją BRAF V600E , najbardziej agresywną postacią raka skóry.
6 listopada 2017 r. FDA zatwierdziła Vemurafenib do leczenia niektórych pacjentów z chorobą Erdheima-Chestera (ECD), rzadkim typem nowotworu histiocytarnego.
Mechanizm akcji
Vemurafenib wywołuje zaprogramowaną śmierć komórkową w czerniaka linii komórkowych. Vemurafenib przerywa etap B-Raf / MEK na szlaku B-Raf / MEK / ERK - jeśli B-Raf ma wspólną mutację V600E.
Wemurafenib działa tylko u pacjentów z czerniakiem, u których nowotwór ma mutację V600E BRAF (to znaczy, w pozycji aminokwasu numer 600 w białku B-Raf normalna walina jest zastąpiona kwasem glutaminowym ). Około 60% czerniaków ma tę mutację. Wykazuje również skuteczność przeciwko rzadszej mutacji BRAF V600K. Komórki czerniaka bez tych mutacji nie są hamowane przez wemurafenib; lek paradoksalnie stymuluje prawidłowy BRAF i może w takich przypadkach sprzyjać wzrostowi guza.
Odporność
Odkryto trzy mechanizmy oporności na wemurafenib (obejmujące 40% przypadków):
- Komórki rakowe zaczynają nadmiernie wyrażać białko powierzchniowe komórki PDGFRB , tworząc alternatywny szlak przeżycia.
- Drugi onkogen zwany NRAS mutuje, reaktywując normalny szlak przeżycia BRAF.
- Wydzielanie przez komórki zrębowe czynnika wzrostu hepatocytów (HGF).
Badania kliniczne
W badaniu klinicznym I fazy wemurafenib (wtedy znany jako PLX4032) był w stanie zmniejszyć liczbę komórek nowotworowych w ponad połowie grupy 16 pacjentów z zaawansowanym czerniakiem. W grupie leczonej średni czas przeżycia wydłużył się o 6 miesięcy w porównaniu z grupą kontrolną.
Drugie badanie fazy I, u pacjentów z mutacją V600E w B-Raf, ~80% wykazało częściową lub całkowitą regresję. Regresja trwała od 2 do 18 miesięcy.
Na początku 2010 roku trwały badania fazy I dotyczące guzów litych (w tym raka jelita grubego ) oraz badania fazy II (w przypadku czerniaka z przerzutami).
Badanie III fazy (w porównaniu z dakarbazyną ) u pacjentów z wcześniej nieleczonym czerniakiem z przerzutami wykazało poprawę wskaźników przeżycia całkowitego i wolnego od progresji choroby.
W czerwcu 2011 r. zgłoszono pozytywne wyniki badania III fazy z mutacją czerniaka BRIM3 BRAF. Próba BRIM3 wykazała dobre zaktualizowane wyniki w 2012 roku.
Planowane są dalsze badania , w tym badanie z wemurafenibem w skojarzeniu z GDC-0973 ( kobimetynib ) , inhibitorem MEK . Po dobrych wynikach w 2014 roku połączenie zostało przedłożone KE i FDA do zatwierdzenia do obrotu.
W styczniu 2015 roku w wynikach badania porównano wemurafenib z połączeniem dabrafenibu i trametynibu w leczeniu przerzutowego czerniaka.
Skutki uboczne
Przy maksymalnej tolerowanej dawce (MTD) 960 mg dwa razy na dobę u 31% pacjentów występują zmiany skórne, które mogą wymagać chirurgicznego usunięcia. Badanie BRIM-2 objęło 132 pacjentów; Najczęstszymi zdarzeniami niepożądanymi były bóle stawów u 58% pacjentów, wysypka skórna u 52% i nadwrażliwość na światło u 52%. W celu lepszego opanowania skutków ubocznych pewna forma modyfikacji dawki była konieczna u 45% pacjentów. Mediana dawki dobowej wynosiła 1750 mg, 91% MTD.
Próba połączenia wemurafenibu i ipilimumabu została przerwana w kwietniu 2013 roku z powodu objawów toksyczności wątroby .
Bibliografia
Dalsza lektura
- Dziekan L (2017). „Terapia wemurafenibem i genotyp BRAF i NRAS” . W Pratt VM, McLeod HL, Rubinstein WS i in. (wyd.). Podsumowania Genetyki Medycznej . Narodowe Centrum Informacji Biotechnologicznej (NCBI). PMID 28809522 . Identyfikator regału: NBK447416.
Linki zewnętrzne
- „Wemurafenib” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
