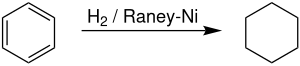Cykloheksan - Cyclohexane
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Cykloheksan |
|||
| Inne nazwy
Heksanaften (archaiczny)
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 3DMet | |||
| 1900225 | |||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Karta informacyjna ECHA |
100.003.461 |
||
| 1662 | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS | |||
| UNII | |||
| Numer ONZ | 1145 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 6 H 12 | |||
| Masa cząsteczkowa | 84,162 g·mol -1 | ||
| Wygląd zewnętrzny | Bezbarwna ciecz | ||
| Zapach | Słodki, benzyna -like | ||
| Gęstość | 0,7739 g/ml, ciecz; Gęstość = 0,996 g/ml, ciało stałe | ||
| Temperatura topnienia | 6,47 ° C (43,65° F; 279,62 K) | ||
| Temperatura wrzenia | 80,74 ° C (177,33 ° F; 353,89 K) | ||
| Niemieszalny | |||
| Rozpuszczalność | Rozpuszczalny w eterze , alkoholu , acetonieaceton | ||
| Ciśnienie pary | 78 mmHg (20 °C) | ||
| -68,13 x 10 -6 cm 3 / mol | |||
|
Współczynnik załamania ( n D )
|
1.42662 | ||
| Lepkość | 1,02 cP w 17 °C | ||
| Termochemia | |||
|
Standardowa entalpia
tworzenia (Δ f H ⦵ 298 ) |
-156 kJ/mol | ||
|
Standardowa entalpia
spalania (Δ c H ⦵ 298 ) |
-3920 kJ/mol | ||
| Zagrożenia | |||
| Arkusz danych dotyczących bezpieczeństwa | Zobacz: strona danych | ||
| Piktogramy GHS |
   
|
||
| Hasło ostrzegawcze GHS | Niebezpieczeństwo | ||
| H225 , H302 , H305 , H315 , H336 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P273 , P280 , P301 + 310 , P302 + 352 , P303 + 361 + 353 , P304 + 340 , P312 , P321 , P331 , P332 + 313 , P362 , P370 +378 , P391 , P403+233 , P403+235 , P405 | |||
| NFPA 704 (ognisty diament) | |||
| Temperatura zapłonu | -20 ° C (-4 ° F; 253 K) | ||
| 245 ° C (473 ° F; 518 K) | |||
| Granice wybuchowości | 1,3-8% | ||
| Dawka lub stężenie śmiertelne (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
12705 mg/kg (szczur, doustnie) 813 mg/kg (mysz, doustnie) |
||
|
LC Lo ( najniższa opublikowana )
|
17 142 ppm (mysz, 2 godz. ) 26 600 ppm (królik, 1 godz.) |
||
| NIOSH (limity ekspozycji dla zdrowia w USA): | |||
|
PEL (dopuszczalne)
|
TWA 300 ppm (1050 mg/m 3 ) | ||
|
REL (zalecane)
|
TWA 300 ppm (1050 mg/m 3 ) | ||
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
1300 ppm | ||
| Związki pokrewne | |||
|
Powiązane cykloalkany
|
Cyklopentan Cykloheptan |
||
|
Związki pokrewne
|
Cykloheksen Benzen |
||
| Strona z danymi uzupełniającymi | |||
|
Współczynnik załamania ( n ), stała dielektryczna (ε r ) itp. |
|||
|
Dane termodynamiczne |
Zachowanie fazowe ciało stałe-ciecz-gaz |
||
| UV , IR , NMR , MS | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Cykloheksan jest cykloalkan o wzorze cząsteczkowym C 6 H 12 . Cykloheksan jest niepolarny . Cykloheksan to bezbarwna, łatwopalna ciecz o charakterystycznym, detergentowym zapachu, przypominającym środki czyszczące (w których bywa stosowany). Cykloheksan stosowany jest głównie do przemysłowego wytwarzania kwasu adypinowego i kaprolaktamu , które są prekursorami do nylonu .
Cykloheksyl ( C 6 H 11 ) oznacza alkil podstawnikiem cykloheksanu i skrócone Cy .
Produkcja
Nowoczesny
Na skalę przemysłową, cykloheksan wytwarzane przez uwodornienie z benzenem , w obecności niklu Raney'a jako katalizatora. Producenci cykloheksanu odpowiadają za około 11,4% światowego zapotrzebowania na benzen. Reakcja jest silnie egzotermiczna, z ΔH(500 K) = -216,37 kJ/mol). Odwodornienie rozpoczęło się zauważalnie powyżej 300 °C, odzwierciedlając korzystną entropię odwodornienia.
Wczesny
W przeciwieństwie do benzenu , cykloheksan nie występuje w zasobach naturalnych, takich jak węgiel. Z tego powodu pierwsi badacze zsyntetyzowali swoje próbki cykloheksanu.
Awaria
- 1867 Marcellin Berthelot zmniejszona benzenu z kwasu jodowodorowego w podwyższonych temperaturach.
- W 1870 Adolf von Baeyer powtórzył reakcję i wymówił ten sam produkt reakcji „heksahydrobenzen”
- w 1890 roku Władimir Markownikow wierzył, że jest w stanie wydestylować ten sam związek z ropy naftowej z Kaukazu , nazywając swoją miksturę „heksanaftenem”.
Nieoczekiwanie, ich cykloheksany gotowane wyższa o 10 ° C niż jednej hexahydrobenzene lub hexanaphtene, ale rzeszoto rozpuszczono w 1895 roku przez Markownikowa, NM Kishnera i Nikolay Zelinsky gdy przypisane „hexahydrobenzene” i „hexanaphtene” jako metylocyklopentan , wynik nieoczekiwany reakcja przegrupowania .
Sukces
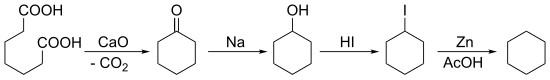
W 1894 roku Baeyer zsyntetyzował cykloheksan, rozpoczynając od ketonizacji kwasu pimelinowego, a następnie wielokrotnych redukcji:
W tym samym roku E. Haworth i WH Perkin Jr. (1860-1929) przygotowali go w reakcji Wurtza 1,6-dibromoheksanu.
Reakcje i zastosowania
Chociaż raczej niereaktywny, cykloheksan ulega katalitycznemu utlenianiu z wytworzeniem cykloheksanonu i cykloheksanolu . Mieszanina cykloheksanon-cykloheksanol, zwana „ olejem KA ”, jest surowcem kwasu adypinowego i kaprolaktamu , prekursorów nylonu . Rocznie produkuje się kilka milionów kilogramów cykloheksanonu i cykloheksanolu.
Jest stosowany jako rozpuszczalnik w niektórych markach płynów korekcyjnych. Cykloheksan jest czasami używany jako niepolarny rozpuszczalnik organiczny, chociaż n-heksan jest w tym celu szerzej stosowany. Jest często stosowany jako rozpuszczalnik do rekrystalizacji , ponieważ wiele związków organicznych wykazuje dobrą rozpuszczalność w gorącym cykloheksanie i słabą rozpuszczalność w niskich temperaturach.
Cykloheksan jest również używany do kalibracji przyrządów do różnicowej kalorymetrii skaningowej (DSC), ze względu na dogodną przemianę kryształ-kryształ w temperaturze -87,1 °C.
Pary cykloheksanu są stosowane w piecach do nawęglania próżniowego, w produkcji urządzeń do obróbki cieplnej.
Struktura
Pierścień krawędzi z 6 wierzchołkami nie odpowiada kształtowi idealnego sześciokąta . Konformacja płaskiego płaskiego sześciokąta 2D ma znaczne odkształcenie kątowe, ponieważ jego wiązania nie mają 109,5 stopnia; skrętnych szczep byłoby również znaczny, ponieważ wszystkie obligacje byłyby obligacje przyćmione . Dlatego, aby zmniejszyć naprężenia skręcające , cykloheksan przyjmuje trójwymiarową strukturę znaną jako konformacja krzesła , która szybko przekształca się w temperaturze pokojowej w procesie znanym jako odwrócenie krzesła . Podczas przewracania krzesła występują trzy inne pośrednie konformacje: półkrzesło, które jest najbardziej niestabilną konformacją, bardziej stabilna konformacja łódki oraz łódka skrętna, która jest bardziej stabilna niż łódka, ale wciąż znacznie mniej stabilny niż krzesło. Krzesło i łódź skrętna są minimami energii, a zatem są konformerami, podczas gdy półkrzesło i łódź są stanami przejściowymi i reprezentują maksima energii. Pomysł, że konformacja krzesła jest najbardziej stabilną strukturą dla cykloheksanu, został po raz pierwszy zaproponowany już w 1890 roku przez Hermanna Sachse, ale zyskał powszechną akceptację znacznie później. Nowa konformacja stawia węgle pod kątem 109,5°. Połowa wodorów znajduje się w płaszczyźnie pierścienia ( równikowej ), podczas gdy druga połowa jest prostopadła do płaszczyzny ( osiowa ). Ta konformacja pozwala na najbardziej stabilną strukturę cykloheksanu. Istnieje inna konformacja cykloheksanu, znana jako konformacja łodzi , ale przekształca się ona w nieco bardziej stabilną formację krzesełkową. Jeśli cykloheksan jest monopodstawiony dużym podstawnikiem , wówczas podstawnik najprawdopodobniej będzie dołączony w pozycji ekwatorialnej, ponieważ jest to nieco bardziej stabilna konformacja .
Cykloheksan ma najniższy kąt i odkształcenie skrętne ze wszystkich cykloalkanów; w rezultacie cykloheksan został uznany za 0 w całkowitym odkształceniu pierścienia.
Fazy stałe
Cykloheksan ma dwie fazy krystaliczne. I faza wysokotemperaturowa, stabilna między 186 K a temperaturą topnienia 280 K, jest kryształem plastycznym , co oznacza, że cząsteczki zachowują pewien rotacyjny stopień swobody. Zamówiono fazę II niskotemperaturową (poniżej 186 K). Dwie inne niskotemperaturowe (metastabilne) fazy III i IV uzyskano przez zastosowanie umiarkowanych ciśnień powyżej 30 MPa, gdzie faza IV występuje wyłącznie w deuterowanym cykloheksanie (zastosowanie ciśnienia zwiększa wartości wszystkich temperatur przejścia).
| Nie | Symetria | Grupa kosmiczna | a (Å) | b (Å) | c (Å) | Z | T (K) | P (MPa) |
|---|---|---|---|---|---|---|---|---|
| i | Sześcienny | Fm3m | 8.61 | 4 | 195 | 0,1 | ||
| II | Jednoskośny | C2/c | 11.23 | 6,44 | 8.20 | 4 | 115 | 0,1 |
| III | rombowe | Pmnn | 6.54 | 7,95 | 5.29 | 2 | 235 | 30 |
| IV | Jednoskośny | P12(1)/n1 | 6,50 | 7,64 | 5,51 | 4 | 160 | 37 |
Tutaj Z jest jednostką struktury liczbowej na komórkę elementarną ; stałe komórki elementarnej a, b i c zostały zmierzone w danej temperaturze T i ciśnieniu P.
Zobacz też
- Katastrofa Flixborough , poważna awaria przemysłowa spowodowana wybuchem cykloheksanu.
- Heksan
- Odwróć pierścień
- Cykloheksan (strona danych)
Bibliografia
- ^ Heksanaften zarchiwizowane 2018-02-12 w Wayback Maszynie , dictionary.com
- ^ „Przód Materia” . Nomenklatura chemii organicznej: zalecenia IUPAC i preferowane nazwy 2013 (Blue Book) . Cambridge: Królewskie Towarzystwo Chemiczne . 2014. s. P001–P004. doi : 10.1039/9781849733069-FP001 . Numer ISBN 978-0-85404-182-4.
- ^ a b c d e Kieszonkowy przewodnik po zagrożeniach chemicznych NIOSH. „#0163” . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ a b „Cykloheksan” . Stężenia bezpośrednio niebezpieczne dla życia lub zdrowia (IDLH) . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ Campbell, M. Larry (2011). „Cykloheksan”. Encyklopedia Chemii Przemysłowej Ullmanna . doi : 10.1002/14356007.a08_209.pub2 . Numer ISBN 978-3527306732.
- ^ „Standardowe skróty i akronimy” (PDF) . Dziennik Chemii Organicznej.
- ^ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng „O obecnych metodach uwodorniania związków aromatycznych, 1945 do dnia dzisiejszego” Lunds Tekniska Högskola 2008
- ^ Ceresana. "Benzen - Badanie: Rynek, Analiza, Trendy 2021 - Ceresana" . www.ceresana.com . Zarchiwizowane z oryginału w dniu 21 grudnia 2017 r . Źródło 4 maja 2018 .
- ^ B Michael Tuttle Musser (2005). „Cykloheksanol i cykloheksanon”. Encyklopedia Chemii Przemysłowej Ullmanna . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a08_217 . Numer ISBN 978-3527306732.
- ^ Warnhoff, EW (1996). „Ciekawie splecione historie benzenu i cykloheksanu”. J.Chem. Wyk. 73 (6): 494. Kod Bib : 1996JChEd..73..494W . doi : 10.1021/ed073p494 .
- ^ Bertholet (1867) „Nouvelles applications des méthodes de réduction en chimie organique” (Nowe zastosowania metod redukcji w chemii organicznej), Bulletin de la Société chimique de Paris , seria 2, 7 : 53-65.
- ^ Bertholet (1868) „Méthode universelle pour réduire et saturer d'hydrogène les composés organiques” (Uniwersalna metoda redukcji i nasycania związków organicznych wodorem), Bulletin de la Société chimique de Paris , seria 2, 9 : 8-31. Od strony 17: "En effet, la benzine, chauffée à 280° pendant 24 heures avec 80 fois son poids d'une solution aqueuse saturée à froid d'acide iodhydrique, se change à peu près entièrement en hydrure d'hexylène, C 12 H 14 , en fixant 4 fois son volume d'hydrogène: C 12 H 6 + 4H 2 = C 12 H 14 … Le nouveau carbure formé par la benzine est un corps unique et défini: il bout à 69°, et offre toutes les własności i skład de l'hydrure d'hexylène extrait des petroles." (W efekcie benzen, ogrzewany do 280° przez 24 godziny z 80 razy większą wagą wodnego roztworu zimnego nasyconego kwasu jodowodorowego, jest prawie całkowicie zamieniany w wodorek heksylenu, C 12 H 14 , [Uwaga: ten wzór dla heksanu ( C 6 H 14 ) jest błędne, ponieważ ówcześni chemicy używali niepoprawnej masy atomowej dla węgla.] ustalając [tj. łącząc z] 4-krotnością jego objętości wodoru: C 12 H 6 + 4 H 2 = C 12 H 14 … nowy związek węgla tworzony przez benzen jest unikalną i dobrze zdefiniowaną substancją: wrze w 69° i posiada wszystkie właściwości i skład wodorku heksylenu wyekstrahowanego z oleju.)
- ^ Adolf Baeyer (1870) „Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium” (O redukcji związków aromatycznych przez jodek fosfoniowy [H 4 IP]), Annalen der Chemie und Pharmacie , 155 : 266-281. Od strony 279: „bei der redukcji mit Natriumamalgam oder Jodphosphonium addiren sich im Höchsten Fälle sechs Atome Wasserstoff, und es entstehen Abkömmlinge, stopów sich von einem Kohlenwasserstoff C 6 H 12 ableiten Dieser Kohlenwasserstoff ist Aller Wahrscheinlichkeit nach ein geschlossener Pierścień Da seine pochodnych. , das Hexahydromesitylen und Hexahydromellithsäure, mit Leichtigkeit wieder in Benzolabkömmlinge übergeführt werden können." (Podczas redukcji [benzenu] amalgamatem sodu lub jodkiem fosfoniowym w skrajnym przypadku dodaje się sześć atomów wodoru i powstają pochodne, które pochodzą od węglowodoru C 6 H 12 . Ten węglowodór jest najprawdopodobniej zamkniętym pierścieniem , ponieważ jego pochodne — heksahydromezytylen [1,3,5-trimetylocykloheksan] i kwas heksahydromellitowy [kwas cykloheksano-1,2,3,4,5,6-heksakarboksylowy] — można z łatwością ponownie przekształcić w pochodne benzenu.)
- ^ Cena, DM (1995). „Kalibracja temperatury różnicowych kalorymetrów skaningowych”. Dziennik Analizy Termicznej . 45 (6): 1285–1296. doi : 10.1007/BF02547423 .
- ^ B Mayer, J .; Urban, S.; Habrylo S.; Holderna K.; Natkaniec, I.; Würflinger, A.; Zając, W. (1991). „Badania rozpraszania neutronów C6H12 i C6D12 cykloheksan pod wysokim ciśnieniem”. Stan fizyczny Solidi B . 166 (2): 381. Kod Bib : 1991PSSBR.166..381M . doi : 10.1002/pssb.2221660207 .
Linki zewnętrzne
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 0242
- Krajowa Inwentaryzacja Zanieczyszczeń – Arkusz informacyjny dotyczący cykloheksanu
- Kieszonkowy przewodnik NIOSH po zagrożeniach chemicznych
- Cykloheksan@3Dchem
- Hermann Sachse i pierwsza propozycja konformacji krzesła.
- Baza danych substancji niebezpiecznych NLM – Cykloheksan
- Metanol odkryty w kosmosie
- Obliczanie prężności pary , gęstości cieczy , dynamicznej lepkości cieczy , napięcia powierzchniowego cykloheksanu
- Schemat procesu produkcji cykloheksanu, technika uwodornienia benzenu