Odkrycie i rozwój inhibitorów NS5A - Discovery and development of NS5A inhibitors
Inhibitory niestrukturalnego białka 5A (NS5A) są bezpośrednio działającymi środkami przeciwwirusowymi (DAA), które są skierowane na białka wirusowe , a ich opracowanie było kulminacją lepszego zrozumienia cyklu życia wirusa w połączeniu z postępami w technologii odkrywania leków. Jednak ich mechanizm działania jest złożony i nie do końca poznany. Inhibitory NS5A były przedmiotem szczególnej uwagi, gdy pojawiły się jako część pierwszego leczenia wirusa zapalenia wątroby typu C(HCV) w 2014 roku. Korzystne cechy zostały wprowadzone poprzez różne zmiany strukturalne, a podobieństwa strukturalne między inhibitorami NS5A, które są klinicznie zatwierdzone, są łatwo widoczne. Pomimo niedawnego wprowadzenia wielu nowych leków przeciwwirusowych, oporność jest nadal problemem i dlatego te inhibitory są zawsze stosowane w połączeniu z innymi lekami.
Wirus zapalenia wątroby typu C
HCV jest wirusem z jednoniciowym RNA o dodatnim znaczeniu , który, jak wykazano, replikuje się w hepatocytach zarówno ludzi, jak i szympansów. Pojedyncza poliproteina HCV ulega translacji, a następnie jest cięta przez proteazy komórkowe i wirusowe na trzy białka strukturalne (rdzeń, E1 i E2) i siedem białek niestrukturalnych (p7, NS2 , NS3 , NS4A , NS4B , NS5A i NS5B ).
HCV jest jedną z głównych przyczyn chorób wątroby na całym świecie. Jest przenoszony przez krew i najczęściej przenoszony przez zainfekowane igły. Pacjenci cierpiący na przewlekłe zakażenie HCV są narażeni na znaczne ryzyko marskości wątroby i raka wątrobowokomórkowego , które są głównymi przyczynami zgonów osób zakażonych.
Wirus istnieje od ponad tysiącleci i został zaklasyfikowany do sześciu znanych genotypów , z których każdy zawiera liczne podtypy. Siódma pozostaje niescharakteryzowana. Zakontraktowany genotyp dyktuje, które konkretne metody leczenia są opłacalne.
Receptor NS5A
Podstawowa struktura i właściwości chemiczne
NS5A jest dużą hydrofilową fosfoproteiną, która jest niezbędna dla cyklu życiowego HCV i występuje w połączeniu z pęcherzykami błonowymi indukowanymi przez wirusy, zwanymi siecią błoniastą. NS5A to bogate w prolinę białko składające się z około 447 aminokwasów , podzielone na trzy domeny. Domeny te są połączone dwiema sekwencjami o niskiej złożoności, które są bogate w serynę lub prolinę . Domena I jest domeną wiążącą cynk, a badania krystalografii rentgenowskiej wykazały alternatywne konformacje dimeru domeny I NS5A. Domeny II i III są nieustrukturyzowane, co wykazały badania NMR. Domena I jest poprzedzona N-końcową helisą amfipatyczną, która umożliwia białku łączenie się z błonami pochodzącymi z retikulum endoplazmatycznego . Chociaż rentgenowskie badania krystalograficzne ujawniły konformacje dimerów domeny NS5A1, ostatnie badania charakteryzacji strukturalnej roztworu wykazały, że białka NS5A tworzą struktury wyższego rzędu przez podjednostki dimeryczne domeny 1 NS5A. Ponadto ogólny model strukturalny NS5A podkreśla zmienność konformacji wewnętrznych domen D2 i D3 między genotypami HCV. Dlatego wciąż trwa debata, która konformacja NS5A jest funkcjonalna, a także jest celem inhibitorów NS5A.
NS5A występuje głównie w dwóch odrębnych formach ufosforylowanych , hipofosforylowanej i hiperfosforylowanej , ale dokładna funkcja fosforylacji nie została określona.
Funkcjonować
Białko NS5A odgrywa ważną rolę w replikacji wirusowego RNA , składaniu wirusów i złożonych interakcjach z funkcjami komórkowymi. Białko bierze udział w modulacji obrony gospodarza, apoptozie , cyklu komórkowym i szlakach reakcji na stres . Jednak jego funkcja i kompletna struktura nie zostały jeszcze wyjaśnione.
NS5A wydaje się mieć kluczowe znaczenie w wyzwalaniu tworzenia sieci błoniastej przy braku innych podobnych białek niestrukturalnych. NS5A może wpływać na wiele białek w komórce gospodarza, np. 4-kinaza fosfatydyloinozytolu IIIα (PI4KIIIα), kinaza wymagana do replikacji HCV. Kinaza ta bierze udział w biosyntezie w fosfatydyloinozytolo-4-fosforan (PI4P) poprzez interakcję z NS5A, który stymuluje jego aktywność i wydaje się poprawiać spójność błoniastego sieci.
Ostatnio centralna rola NS5A w proliferacji wirusa sprawiła, że stał się celem rozwoju leków . W rezultacie do leczenia HCV wprowadzono nowe środki przeciwwirusowe.
Mechanizm akcji
Inhibitory NS5A zostały opracowane w celu ukierunkowania na białko NS5A. Inhibitory te osiągnęły znaczne obniżenie poziomu HCV RNA we krwi i dlatego mogą być uważane za silne leki przeciwwirusowe. Uważa się, że ich mechanizm działania jest różnorodny, ale dokładny mechanizm nie jest w pełni poznany. Większość badań zakłada, że inhibitory NS5A działają na dwóch zasadniczych etapach cyklu życiowego HCV; replikacja genomowego RNA i składanie wirionów. Inne badania proponują zmianę czynników komórki gospodarza jako możliwy trzeci mechanizm.

Struktura inhibitorów NS5A charakteryzuje się symetrią dimeryczną . Sugeruje to, że inhibitory NS5A działają na dimery NS5A. Szereg badań modelowania wykazało, że daklataswir , który jest inhibitorem NS5A, wiąże się tylko z dimerem NS5A „back-to-back” i że wiązanie to musi być symetryczne. Inne badania modelowania wykazały, że możliwe jest wiązanie z innymi konformacjami NS5A, a także wiązanie asymetryczne . Badania wykazały, że celem daklataswiru jest najprawdopodobniej domena I NS5A. Mimo, że mechanizm ten nie jest całkowicie zrozumiały, wykazano, że inhibitory obniżają NS5A hiperfosforylacji, prowadząc do zahamowania replikacji HCV, oraz jego przetwarzanie polibiałek, jak również w wyniku nietypowym miejscu białka. Dotychczas uważano, że to hamowanie wymaga tylko domeny I NS5A, ale nie domen II i III. Jednak ostatnie badania wykazały, że obie domeny I i II są istotne dla tego zakłócenia replikacji RNA.
Inhibitory NS5A wydają się ponadto zakłócać tworzenie nowych kompleksów replikaz, powodując stopniowe spowolnienie syntezy wirusowego RNA. Wpływ na wcześniej powstałe kompleksy nie został jeszcze udowodniony.
Dostępne dowody sugerują, że inhibitory NS5A modyfikują lokalizację NS5A wewnątrz komórki. Może to spowodować nieprawidłowy montaż prowadzący do zniekształconych wirusów. Niektóre badania wykazały, że hamowanie tworzenia się wirusów odgrywa ważniejszą rolę w redukcji RNA niż redukcja replikacji wirusa.
Badania wykazały, że inhibitory NS5A blokują tworzenie błoniastej sieci, która chroni genom wirusa i zawiera główne miejsca replikacji i składania wirusa. Uważa się, że mechanizm ten jest niezależny od replikacji RNA, ale wydaje się, że mają na niego wpływ inhibitory NS5A blokujące tworzenie kompleksu PI4KIIIα-NS5A, niezbędnego do syntezy PI4P, co skutkuje zmniejszoną integralnością sieci błoniastej, a tym samym zmniejszeniem RNA HCV replikacja.
Historia
Badania nad HCV poczyniły w ostatnich latach ogromne postępy dzięki odkryciu i rozwojowi klinicznemu wielu nowych leków przeciw HCV. Wśród tych leków są DAA, które zawierają inhibitory NS5A. Inhibitory NS5A okazały się szczególnie skuteczne w leczeniu HCV, gdy były stosowane w połączeniu z innymi inhibitorami proteazy, takimi jak inhibitory NS5B (np. sofosbuwir ), pegylowane interferony (np. peginterferon alfa-2a ) i analogi rybonukleinowe (np. rybawiryna ). Zawsze obecne ryzyko rozwoju oporności szczepów wirusowych było głównym czynnikiem powodującym, że są one stosowane w połączeniu z jednym lub większą liczbą leków uzupełniających.
Działania niepożądane oraz rozległe i skomplikowane schematy leczenia z towarzyszącymi niskimi wskaźnikami przestrzegania zaleceń były przeszkodą w rozwoju terapii przeciwwirusowych. Połączenie inhibitorów NS5A i NS5B dało w tym względzie pozytywne wyniki.
Odkrywanie i rozwój leków
Odkrycie

Odkrycie inhibitorów NS5A miało miejsce w kontekście poszukiwań leczenia HCV. NS5A jest jednym z siedmiu białek niestrukturalnych, które tworzą kompleks z wirusowym RNA w zakażonych komórkach w celu zainicjowania replikacji HCV. Badania HCV przyniosły kilka DAA, w tym inhibitory NS3A, NS4A i NS5B, a także inhibitory NS5A.
Rozwój
Opracowanie leków przeciwwirusowych zdolnych do zakłócania białek odpowiedzialnych za replikację wirusa jest ściśle powiązane z postępami w technikach tworzenia wydajnych systemów hodowli komórkowych potrzebnych do ich badań przesiewowych .
W 1999 r. nastąpił przełom, kiedy odkryto, że pełnej długości genom konsensusowy sklonowany z HCV RNA replikuje na wysokim poziomie po transfekcji do linii komórek ludzkiego wątrobiaka . Metoda ta została od tego czasu ulepszona przez zastosowanie mutacji adaptacyjnych do hodowli komórkowych, które wzmacniają replikację RNA.
Badania przesiewowe wyprodukowały obecnie szereg inhibitorów NS5A, które zostały włączone do leczenia HCV. Pierwszym w tej nowej klasie leków był daklataswir (Daklinza), który w lipcu 2014 r. uzyskał pierwszą globalną aprobatę japońskiego Ministerstwa Zdrowia, Pracy i Opieki Społecznej (MHLW) w połączeniu z asunaprewirem. Daklataswir otrzymał zatwierdzenie FDA w lipcu 2015 r. Od tego czasu zatwierdzono inne leki, w tym w szczególności pierwszy zatwierdzony przez FDA inhibitor NS5A ledipaswir , zatwierdzony w październiku 2014 r. w połączeniu z sofosbuwirem w celu włączenia leku HCV Harvoni .
Chociaż inhibitory NS5A okazały się skutecznymi lekami przeciwwirusowymi, muszą być stosowane razem z uzupełniającymi lekami przeciwwirusowymi ze względu na to, jak szybko prowadzą do rozwoju mutacji opornych, gdy są podawane jako pojedynczy środek. To ukształtowało kierunek rozwoju inhibitorów NS5A, z których , między innymi, wyłoniły się asymetryczne warianty metabolizowane do analogów o komplementarnych profilach oporności.
Relacja struktura-aktywność
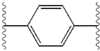
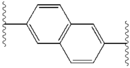
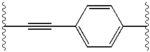
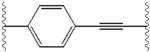
Podobieństwa strukturalne między inhibitorami są łatwo widoczne. Wyrostki centralnego rdzenia są zazwyczaj symetryczne i mają strukturę imidazol- prolina. Stwierdzono, że naturalna konfiguracja L pochodnych proliny jest krytyczna dla hamowania, ponieważ nienaturalna konfiguracja D ma drastycznie słabszą aktywność. Siła działania inhibitorów była odpowiednio wrażliwa na zmiany w aminowym elemencie przykrywającym. Obserwacje te sugerują, że region aminowy cząsteczek odgrywa ważną rolę w aktywności hamującej.
Korzystne cechy inhibitora NS5A obejmują wysoką moc i długi okres półtrwania w osoczu w celu uzyskania dawki raz na dobę. Stwierdzono, że nieznacznie asymetryczne wyrostki, jak widać w przypadku ledipaswiru, przynoszą wyraźne korzyści w zakresie optymalizacji siły działania inhibitora i farmakokinetyki . Struktura rdzenia centralnego zmienia rozmieszczenie i rzut wyrostków oraz położenie lipofilności w rdzeniu centralnym, co w znacznym stopniu wpływa na aktywność hamującą. Struktury ze skondensowanymi pierścieniami centralnymi konsekwentnie wykazują większą aktywność hamującą, podczas gdy mniej lipofilowe rdzenie centralne zapewniają słabszą aktywność. Symetryczne struktury bis-imidazol, takie jak daklataswir doświadczają utraty siły działania, gdy fluoren jest podstawiony na biarylowej grupy. To zastąpienie powoduje również poważne problemy ze stabilnością. Jednak mniejszy łącznik lipofilowy, taki jak difluorometylen, generuje najsilniejszy inhibitor w strukturze asymetrycznej. Dodatkowo zapewnia lepszą biodostępność i korzystniejszy okres półtrwania w osoczu. Istnieje również znaczący wzrost siły działania, gdy fenyl jest zastąpiony naftylem jako centralnym rdzeniem. Ten wzrost jest znacznie wyższy w strukturze asymetrycznej niż w strukturze symetrycznej. W strukturach asymetrycznych różnica w sile działania pomiędzy inhibitorami fenyloalkinu wskazuje na znaczenie położenia lipofilności. Bardziej centralnie położony alkin, który jest mniej lipofilowym łącznikiem niż fenyl, poprawia siłę działania.
| Struktura | Działalność | |
|---|---|---|
| x | IC 50 (nM) | Aktywność hamująca |
| >44 | Nic | |
| >44 | Nic | |
| 11 | Bardzo słaby | |
| 1,7 | Słaby | |
| 0,50 | Umiarkowany | |
| 3,7 | Słaby | |
| 0,11 | Umiarkowany | |
| 0,20 | Umiarkowany | |
| Struktura | Działalność | |
|---|---|---|
| x | IC 50 (nM) | Aktywność hamująca |
| >44 | Nic | |
| 0,071 | Umiarkowany | |
| 2,5 | Słaby | |
| 0,38 | Umiarkowany | |
| 0,20 | Umiarkowany | |
| 0,17 | Umiarkowany | |
| 0,040 | Silny | |
| Struktura | Działalność | |
|---|---|---|
| x | IC 50 (nM) | Aktywność hamująca |
| CO 2 | 0,094 | Silny |
| WSPÓŁ | 0,30 | Umiarkowany |
| C (CH 3 ) 2 | 1.2 | Słaby |
Opór
Potencjalna oporność HCV na leki DAA jest problemem. Wśród quasigatunków HCV istnieją wcześniej istniejące warianty, które mogą nadawać oporność na inhibitory NS5A bez wcześniejszej ekspozycji na te leki. Generalnie replikacja tych wariantów zachodzi tylko w niewielkich ilościach, co czyni je niewykrywalnymi przez obecne techniki. Z drugiej strony możliwa jest selektywna hodowla wariantów immunologicznych w obecności inhibitorów NS5A. Odporność na HCV charakteryzuje się pewnym wzorcem ucieczki. Ten wzorzec jest często związany z podstawieniami aminokwasów, które nadają wirusowi silną lekooporność bez pogarszania sprawności wirusa. Ustalono, że inhibitory NS5A mają stosunkowo niski próg oporności i wykazano, że warianty związane z opornością na NS5A wytrzymują u pacjentów do sześciu miesięcy po zaprzestaniu leczenia. Dlatego terapie skojarzone zapewniają wyższą skuteczność i krótsze okresy leczenia.
Przyszłe badania i nowe generacje inhibitorów NS5A
W nadchodzących latach deweloperzy DAA staną przed przewidywalnymi wyzwaniami. Trzeba będzie wypełnić luki terapeutyczne dla osób cierpiących na skomplikowane schorzenia, takie jak przewlekła choroba nerek i marskość wątroby. Krótsze terapie z łagodniejszymi skutkami ubocznymi zapewniłyby lepsze przyleganie, a widmo oporności na leki zbliża się. Wysoce adaptacyjny HCV wyewoluował w szereg różnych genomów, z których wszystkie muszą być odpowiednio leczone, najlepiej za pomocą schematów pangenotypowych.
Niektóre z tych wyzwań mają już możliwe rozwiązania. Inhibitor proteazy ABT-493 i inhibitor nowej generacji ABT-530 NS5A są uważane za aktywne przeciwko wszystkim genotypom HCV, w tym trudnemu do leczenia genotypowi 3. In vitro, ABT-530 wykazał silne działanie przeciwko wariantom związanym z opornością, które są odporne na pierwsze generacje inhibitorów NS5A, w tym ledipaswir, daklataswir i ombitaswir . Ponieważ ta kombinacja leków ma dodatkową zaletę, że jest usuwana przez wątrobę, daje nadzieję, że pacjenci cierpiący na przewlekłą chorobę nerek i HCV będą mogli w najbliższej przyszłości otrzymać bezpieczną, nieopartą na sofosbuwirze terapię.
Co najmniej trzy kombinacje leków do leczenia HCV są w przygotowaniu do zatwierdzenia w latach 2016-2017: Sofosbuvir w połączeniu z welpataswirem , ABT-493 w połączeniu z ABT-530 i grazoprewir w połączeniu z elbaswirem , w tym welpataswir, ABT -530 i elbaswir są inhibitorami NS5A.