Erdafitynib - Erdafitinib
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Balversa |
| Inne nazwy | JNJ-42756493 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a619031 |
| Dane licencyjne | |
| Drogi administracji |
Ustami |
| Klasa leków | Związki azotu organicznego |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Identyfikator SID PubChem | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Karta informacyjna ECHA |
100.235.008 |
| Dane chemiczne i fizyczne | |
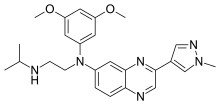
| Formuła | C 25 H 30 N 6 O 2 |
| Masa cząsteczkowa | 446,555 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Erdafitynib jest drobnocząsteczkowym inhibitorem receptora czynnika wzrostu fibroblastów (FGFR) zatwierdzonym do leczenia raka i sprzedawanym pod nazwą Balversa . FGFR są podzbiorem kinaz tyrozynowych, które są nieregulowane w niektórych nowotworach i wpływają na różnicowanie komórek nowotworowych , proliferację, angiogenezę i przeżycie komórek. Firma Astex Pharmaceuticals odkryła lek i udzieliła licencji firmie Janssen Pharmaceuticals w celu dalszego rozwoju .
Naukowcy badali erdafitinib dla bezpieczeństwa i skuteczności w leczeniu przewodów żółciowych , raka żołądka , niedrobnokomórkowego raka płuc i raka przełyku .
W marcu 2018 r. erdafitynib uzyskał przełomowe oznaczenie terapii przez amerykańską Agencję ds. Żywności i Leków (FDA) do leczenia raka urotelialnego .
W kwietniu 2019 r. erdafitynib został zatwierdzony przez FDA do leczenia przerzutowego lub miejscowo zaawansowanego raka pęcherza moczowego ze zmianą FGFR3 lub FGFR2, która wyszła poza tradycyjne terapie oparte na platynie, z zastrzeżeniem badania potwierdzającego. Amerykańska Agencja ds. Żywności i Leków (FDA) uważa go za lek pierwszej klasy .
Dawkowanie
Erdafitynib to tabletka przyjmowana raz na dobę w łącznej dawce 8 mg. W trakcie leczenia w razie potrzeby dawkę erdafitynibu można zwiększyć do 9 mg.
Skutki uboczne
Częste działania niepożądane obejmują podwyższony poziom fosforanów, owrzodzenia jamy ustnej, uczucie zmęczenia, zmiany w czynności nerek, biegunkę, suchość w ustach, odrywanie się paznokci od łożyska lub słabe tworzenie się paznokcia, zaburzenia czynności wątroby, niski poziom soli (sodu), zmniejszony apetyt , zmiana odczuwania smaku, zmniejszenie liczby czerwonych krwinek (niedokrwistość), suchość skóry, suchość oczu i wypadanie włosów. Inne działania niepożądane obejmują zaczerwienienie, obrzęk, łuszczenie lub tkliwość dłoni lub stóp (zespół dłoniowo-podeszwowy), zaparcia, ból brzucha, nudności i bóle mięśni.
Erdafitynib może powodować poważne problemy z oczami, w tym zapalenie oczu, zapalenie rogówki (przednia część oka) i zaburzenia siatkówki, wewnętrznej części oka. Pacjentom zaleca się przeprowadzanie okresowych badań wzroku i natychmiastowe poinformowanie pracownika służby zdrowia o niewyraźnym widzeniu, utracie wzroku lub innych zmianach wzrokowych.
Historia
Skuteczność erdafitinibu badano w badaniu klinicznym (NCT02365597), w którym wzięło udział 87 osób dorosłych z miejscowo zaawansowanym lub przerzutowym rakiem pęcherza moczowego, ze zmianami genetycznymi FGFR3 lub FGFR2, u których doszło do progresji po leczeniu chemioterapią. Całkowity odsetek odpowiedzi u tych dorosłych wyniósł 32,2%, przy 2,3% pełnej odpowiedzi i prawie 30% częściowej odpowiedzi. Odpowiedź trwała średnio około pięciu i pół miesiąca. Proces przeprowadzono w Azji, Europie i Stanach Zjednoczonych.
Erdafitynib otrzymał przyspieszoną aprobatę. Konieczne są dalsze badania kliniczne w celu potwierdzenia korzyści klinicznych ze stosowania erdafitinibu, a sponsor prowadzi lub planuje przeprowadzić te badania. Erdafitynibowi nadano również przełomowe oznaczenie terapii .
FDA zatwierdziła Balversa firmie Janssen Pharmaceutical. FDA zatwierdziła również zestaw therascreen FGFR RGQ RT-PCR, opracowany przez firmę Qiagen Manchester, Ltd. do stosowania jako diagnostyka towarzysząca z Balversa w tym wskazaniu terapeutycznym.
Bibliografia
Linki zewnętrzne
- „Erdafitynib” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
- „Pakiet zatwierdzający lek: Balversa (erdafinitib)” . Amerykańska Agencja ds. Żywności i Leków (FDA) .
