Węzeł szczelinowy - Gap junction
| Węzeł szczelinowy | |
|---|---|
 Połączenie szczelinowe kręgowców
| |
| Identyfikatory | |
| Siatka | D017629 |
| NS | H1.00.01.1.02024 |
| FMA | 67423 |
| Terminologia anatomiczna | |
Połączenia szczelinowe to wyspecjalizowane połączenia międzykomórkowe między wieloma typami komórek zwierzęcych . Łączą one bezpośrednio cytoplazmę dwóch komórek, co umożliwia różnym cząsteczkom , jonom i impulsom elektrycznym bezpośrednie przejście przez regulowaną bramkę między komórkami.
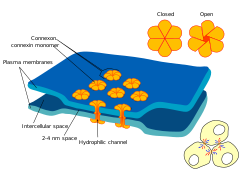
Jeden kanał złącza szczelinowego składa się z dwóch heksamerów białkowych (lub półkanałów) zwanych koneksonami u kręgowców i ineksonami u bezkręgowców. Para półkanałów łączy się w przestrzeni międzykomórkowej, wypełniając lukę między dwiema komórkami. Połączenia szczelinowe są analogiczne do plasmodesmata, które łączą komórki roślinne.
Połączenia szczelinowe występują praktycznie we wszystkich tkankach ciała, z wyjątkiem dorosłych, w pełni rozwiniętych mięśni szkieletowych i mobilnych typów komórek, takich jak plemniki czy erytrocyty . Połączenia szczelinowe nie znajdują się w prostszych organizmach, takich jak gąbki i śluzowce .
Połączenie szczelinowe można również nazwać nexus lub macula communicans . Chociaż efapsa ma pewne podobieństwa do złącza szczelinowego, we współczesnej definicji są one różne.
Struktura
W kręgowców , spoina szczelina hemichannels są głównie homo lub hetero - heksamery o koneksyny białek . Połączenia szczelinowe bezkręgowców zawierają białka z rodziny inneksyn . Inneksyny nie wykazują znaczącej homologii sekwencji z koneksynami. Chociaż różnią się sekwencją od koneksyn, inneksyny są na tyle podobne do koneksyn, że można stwierdzić, że inneksyny tworzą połączenia szczelinowe in vivo w taki sam sposób, jak koneksyny. Niedawno scharakteryzowana rodzina panneksyn , o której pierwotnie sądzono, że tworzy kanały międzykomórkowe (o sekwencji aminokwasowej podobnej do inneksyn), w rzeczywistości działa jako kanał jednobłonowy, który komunikuje się ze środowiskiem zewnątrzkomórkowym i wykazano, że przepuszcza wapń i ATP .
W połączeniach szczelinowych przestrzeń międzykomórkowa wynosi od 2 do 4 nm, a kanały półprzewodnikowe w błonie każdej komórki są wyrównane względem siebie.
Kanały połączeń szczelinowych utworzone z dwóch identycznych półkanałów nazywane są homotypowymi, podczas gdy te z różnymi półkanałami są heterotypowe. Z kolei hemikanały o jednolitym składzie białkowym nazywane są homomerycznymi, podczas gdy te z różnymi białkami są heteromeryczne . Skład kanałów wpływa na funkcję kanałów połączeń szczelinowych.
Zanim inneksyny i koneksyny zostały dobrze scharakteryzowane, geny kodujące kanały połączeń szczelinowych koneksyny zostały sklasyfikowane w jednej z trzech grup na podstawie mapowania genów i podobieństwa sekwencji : A, B i C (np. GJA1 , GJC1 ). Jednak geny koneksyny nie kodują bezpośrednio ekspresji kanałów połączeń szczelinowych; geny mogą wytwarzać tylko białka tworzące kanały połączeń szczelinowych. Popularny jest również alternatywny system nazewnictwa oparty na masie cząsteczkowej tego białka (na przykład: connexin43=GJA1, connexin30.3=GJB4).
Poziomy organizacji
- Geny półkanałowe (DNA) są transkrybowane na RNA, które jest następnie tłumaczone w celu wytworzenia białek półkanałowych.
- Jedno białko półkanałowe ma cztery domeny transbłonowe
- 6 białek hemikanałowych tworzy jeden hemikanał. Kiedy różne białka hemikanałów łączą się ze sobą, tworząc jeden hemikanał, nazywa się to hemikanałem heteromerycznym.
- Dwa półkanały połączone ze sobą przez błonę komórkową tworzą kanał Gap Junction.
Kiedy dwa identyczne białka półkanałowe łączą się, tworząc kanał połączenia Gap, nazywa się to homotypowym kanałem GJ. Kiedy jeden homomeryczny półkanał i jeden heteromeryczny półkanał łączą się, nazywa się to heterotypowym kanałem złącza szczelinowego. Kiedy łączą się dwa hemikanały heteromeryczne, nazywa się to również kanałem heterotypowym Gap Junction. - Kanały połączenia szczelinowego (od dziesiątek do tysięcy) gromadzą się w kompleksie makrocząsteczkowym zwanym płytką połączenia szczelinowego.
Właściwości par półkanałowych
Para kanałów półkanałowych:
- Umożliwia bezpośrednią komunikację elektryczną między komórkami, chociaż różne podjednostki półkanałowe mogą nadawać różne przewodności pojedynczego kanału , od około 30 pS do 500 pS.
- Umożliwia komunikację chemiczną między komórkami, poprzez transmisję małych sekundowych przekaźników , takich jak trifosforan inozytolu ( IP
3) i wapń ( Ca2+
), chociaż różne podjednostki półkanałowe mogą nadawać różną selektywność dla poszczególnych małych cząsteczek. - Ogólnie rzecz biorąc, umożliwia transbłonowy ruch cząsteczek mniejszych niż 485 Daltonów (1100 Daltonów przez połączenia szczelinowe bezkręgowców), chociaż różne podjednostki półkanałowe mogą nadawać różne rozmiary porów i inną selektywność ładunku. Duże biocząsteczki, na przykład kwas nukleinowy i białko , są wykluczone z transferu cytoplazmatycznego między komórkami przez pary półkanałowych połączeń szczelinowych.
- Zapewnia, że cząsteczki i prąd przechodzący przez złącze szczelinowe nie przedostają się do przestrzeni międzykomórkowej.
Do tej pory białku połączenia szczelinowego przypisano pięć różnych funkcji :
- Sprzężenie elektryczne i metaboliczne między komórkami
- Wymiana elektryczna i metaboliczna przez kanały półprzewodnikowe
- Geny supresorowe nowotworu ( Cx43 , Cx32 i Cx36 )
- Funkcja adhezyjna niezależna od przewodzącego kanału złącza szczelinowego (migracja neuronalna w korze nowej)
- Rola końca karboksylowego w sygnalizacji szlaków cytoplazmatycznych (Cx43)
Występowanie i dystrybucja
Połączenia szczelin zaobserwowano w różnych narządach i tkankach zwierząt, w których komórki stykają się ze sobą. Od 1950 do 1970 roku zostały one wykryte w raków nerwów, trzustki, wątroby szczura, kory nadnerczy, najądrza, dwunastnicy, mięśni, Daphnia wątroby kątnicy , Hydra mięśni, małpa siatkówki, rogówki królika, ryby zarodkowej , żaba zarodków jajnika królika, ponownie agregacja komórek, kapsułki hemocytów karalucha, skóra królika, zarodki kurcząt, ludzka wysepka Langerhansa, receptory akustyczno-przedsionkowe wyczuwające ciśnienie u złotych rybek i chomików, serce minoga i osłonicy, kanaliki nasienne szczura, myometrium , soczewka oka i nabłonek trawienny głowonogów. Od lat 70. połączenia szczelinowe nadal znajdują się w prawie wszystkich stykających się ze sobą komórkach zwierzęcych. W latach 90. nowa technologia, taka jak mikroskopia konfokalna, umożliwiła szybsze badanie dużych obszarów tkanki. Od lat 70. nawet tkanki, które tradycyjnie uważano za potencjalnie posiadające izolowane komórki, takie jak kość, wykazały, że komórki nadal były połączone połączeniami szczelinowymi, jakkolwiek słabo. Wydaje się, że połączenia szczelinowe znajdują się we wszystkich narządach i tkankach zwierząt i interesujące będzie znalezienie wyjątków od tego innych niż komórki, które normalnie nie mają kontaktu z sąsiednimi komórkami. Możliwym wyjątkiem jest dorosły mięsień szkieletowy. Można argumentować, że jeśli są obecne w mięśniach szkieletowych, połączenia szczelinowe mogą w dowolny sposób propagować skurcze między komórkami tworzącymi mięsień. Przynajmniej w niektórych przypadkach może tak nie być, jak pokazano w innych typach mięśni, które mają połączenia szczelinowe. O tym, co wynika ze zmniejszenia lub braku połączeń szczelinowych, może wskazywać analiza nowotworów lub procesu starzenia.
Funkcje
Można zauważyć, że połączenia szczelinowe działają na najprostszym poziomie jako bezpośrednia ścieżka między komórkami dla prądów elektrycznych, małych cząsteczek i jonów. Kontrola tej komunikacji umożliwia złożone następstwa na organizmy wielokomórkowe, jak opisano poniżej.
Rozwój embrionalny, narządów i tkanek
W latach 80. badano bardziej subtelne, ale nie mniej ważne role komunikacji typu gap-connection. Odkryto, że komunikacja między szczelinami może zostać zakłócona przez dodanie przeciwciał przeciwko koneksynie do komórek embrionalnych. Zarodki z obszarami zablokowanych połączeń szczelinowych nie rozwijały się normalnie. Mechanizm, za pomocą którego przeciwciała blokowały połączenia szczelinowe, był niejasny, ale w celu wyjaśnienia mechanizmu podjęto systematyczne badania. Udoskonalenie tych badań wykazało, że połączenia szczelinowe wydają się być kluczem do rozwoju polaryzacji komórek i symetrii/asymetrii lewo/prawo u zwierząt. Podczas gdy sygnalizacja determinująca położenie narządów ciała wydaje się opierać na połączeniach szczelinowych, tak samo bardziej fundamentalne różnicowanie komórek na późniejszych etapach rozwoju embrionalnego. Stwierdzono również, że połączenia szczelinowe są odpowiedzialne za przekazywanie sygnałów wymaganych do działania leków i odwrotnie wykazano, że niektóre leki blokują kanały połączeń szczelinowych.
Węzły szczelinowe i „efekt przechodnia”
Śmierć komórki
„Efekt przechodnia” z konotacją niewinnego przechodnia, który zostaje zabity, jest również zapośredniczony przez połączenia szczelinowe. Kiedy komórki są zagrożone z powodu choroby lub urazu i zaczynają umierać, wiadomości są przekazywane do sąsiednich komórek połączonych z umierającą komórką za pomocą połączeń szczelinowych. Może to spowodować śmierć zdrowych, zdrowych komórek postronnych. Dlatego też należy wziąć pod uwagę efekt przechodnia w przypadku chorych komórek, co otworzyło drogę do większego finansowania i rozkwitu badań. Później zbadano również efekt przechodnia w odniesieniu do komórek uszkodzonych przez promieniowanie lub urazy mechaniczne, a tym samym gojenie się ran. Wydaje się, że choroba ma również wpływ na zdolność połączeń szczelinowych do pełnienia swojej roli w gojeniu się ran.
Restrukturyzacja tkanek
Chociaż istnieje tendencja do skupiania się na efektach przechodniów w chorobie ze względu na możliwość możliwości terapeutycznych, istnieją dowody na to, że w prawidłowym rozwoju tkanek odgrywa ona bardziej centralną rolę. Do osiągnięcia ostatecznej konfiguracji przez tkankę może być wymagana śmierć niektórych komórek i otaczającej ich macierzy, a połączenia szczelinowe również wydają się istotne dla tego procesu. Istnieją również bardziej złożone badania, które próbują połączyć nasze zrozumienie jednoczesnej roli połączeń szczelinowych zarówno w gojeniu ran, jak i rozwoju tkanek.
Obszary sprzężenia elektrycznego
Połączenia szczelinowe elektrycznie i chemicznie łączą komórki w ciele większości zwierząt. Sprzężenie elektryczne może działać stosunkowo szybko. Tkanki w tej sekcji mają dobrze znane funkcje, które zaobserwowano jako koordynowane przez połączenia szczelinowe z sygnalizacją międzykomórkową zachodzącą w ramach czasowych wynoszących mikrosekundy lub mniej.
Serce
Połączenia szczelinowe są szczególnie ważne w mięśniu sercowym : sygnał do skurczu jest skutecznie przekazywany przez połączenia szczelinowe, umożliwiając komórkom mięśnia sercowego jednoczesne kurczenie się.
Neurony
Połączenie szczelinowe zlokalizowane w neuronach jest często nazywane synapsą elektryczną . Synapsę elektryczną odkryto za pomocą pomiarów elektrycznych przed opisaniem struktury złącza szczelinowego. Synapsy elektryczne są obecne w ośrodkowym układzie nerwowym i badano szczególnie w korze mózgowej , hipokampie , przedsionkowy jądra , wzgórzowy siatkowy jądra , miejsce sinawe , niższy jądro oliwkowe , śródmózgowia jądra nerwu trójdzielnego , brzuszne nakrywki obszar , opuszki węchowej , siatkówce i rdzeń kręgowy od kręgowców .
Zaobserwowano pewne sprzęganie słabych neuronów z komórkami glejowymi w miejscu sinawym oraz w móżdżku między neuronami Purkinjego a komórkami glejowymi Bergmanna . Wydaje się, że astrocyty są połączone połączeniami szczelinowymi, zarówno z innymi astrocytami, jak i oligodendrocytami . Ponadto mutacje w genach połączeń szczelinowych Cx43 i Cx56.6 powodują zwyrodnienie istoty białej podobne do obserwowanego w chorobie Pelizaeusa-Merzbachera i stwardnieniu rozsianym .
Białka koneksyny wyrażane w połączeniach szczelinowych neuronów obejmują:
z mRNA dla co najmniej pięciu innych koneksyn ( mCx26 , mCx30,2 , mCx32 , mCx43 , mCx47 ) wykrytych, ale bez dowodów immunocytochemicznych na odpowiadające białko w obrębie złącz szczelinowych o ultrastrukturalnie zdefiniowanej strukturze. Wydaje się, że te mRNA są regulowane w dół lub niszczone przez mikrointerferujące RNA ( miRNA ), które są specyficzne dla typu komórki i linii komórkowej.
Siatkówka oka
Neurony w siatkówce wykazują rozległe sprzężenie, zarówno w populacjach jednego typu komórek, jak i między różnymi typami komórek.
Odkrycie
Nazewnictwo
Połączenia szczelinowe zostały nazwane tak ze względu na "przerwę" występującą w tych specjalnych połączeniach między dwiema komórkami. Dzięki zwiększonej rozdzielczości transmisyjnego mikroskopu elektronowego (TEM) struktury połączeń szczelinowych po raz pierwszy można było zobaczyć i opisać około 1953 roku.

Termin „połączenie szczelinowe” pojawił się około 16 lat później, około 1969 roku. Podobna wąska regularna szczelina nie została wykazana w innych połączeniach międzykomórkowych sfotografowanych wówczas przy użyciu TEM.
Tworzą wskaźnik funkcji
Na długo przed demonstracją „luki” w połączeniach szczelinowych były one widoczne na połączeniu sąsiednich komórek nerwowych. Bliskie sąsiedztwo sąsiednich błon komórkowych na złączu szczelinowym skłoniło naukowców do spekulacji, że odgrywają one rolę w komunikacji międzykomórkowej, w szczególności w transmisji sygnałów elektrycznych. Połączenia szczelinowe okazały się również prostować elektrycznie i określane jako synapsa elektryczna . Później odkryto, że chemikalia mogą być również transportowane między komórkami przez połączenia szczelinowe.
Domyślne lub wyraźne w większości wczesnych badań jest to, że obszar połączenia szczelinowego różnił się strukturą od otaczających błon w sposób, który sprawiał, że wyglądał inaczej. Wykazano, że połączenie szczelinowe tworzy mikrośrodowisko między dwiema komórkami w przestrzeni zewnątrzkomórkowej lub „luce”. Ta część przestrzeni pozakomórkowej była nieco odizolowana od otaczającej przestrzeni, a także połączona z mostem przez to, co teraz nazywamy parami koneksonów, które tworzą jeszcze bardziej szczelne mostki, które przecinają szczelinę w łączeniu szczelin między dwiema komórkami. Przy oglądaniu w płaszczyźnie błony za pomocą technik zamrażania-złamania możliwy jest rozkład koneksonów w wyższej rozdzielczości w obrębie płytki połączenia szczelinowego.
W niektórych skrzyżowaniach obserwuje się wyspy wolne od koneksyny. Obserwacja była w dużej mierze bez wyjaśnienia, dopóki Peracchia nie pokazał pęcherzyków przy użyciu cienkich przekrojów TEM, aby systematycznie kojarzyć się z płytkami połączeń szczelinowych. Badanie Peracchii było prawdopodobnie pierwszym badaniem opisującym sparowane struktury connexon, które nazwał po prostu „globulą”. Badania wykazujące pęcherzyki związane z połączeniami szczelinowymi i sugerujące, że zawartość pęcherzyka może przemieszczać się w poprzek płytek łączących między dwiema komórkami były rzadkie, ponieważ większość badań skupiała się raczej na koneksonach niż na pęcherzykach. Późniejsze badanie z wykorzystaniem kombinacji technik mikroskopowych potwierdziło wczesne dowody prawdopodobnej funkcji połączeń szczelinowych w międzykomórkowym przenoszeniu pęcherzyków. Obszary transferu pęcherzyków były związane z wyspami wolnymi od koneksyny w obrębie płytek połączeń szczelinowych.
Synapsy elektryczne i chemiczne nerwów
Z powodu powszechnego występowania połączeń szczelinowych w typach komórek innych niż komórki nerwowe, termin połączenie szczelinowe stał się powszechnie używany niż terminy takie jak synapsa elektryczna lub nexus. Inny wymiar związku między komórkami nerwowymi a połączeniami szczelinowymi został ujawniony przez badanie tworzenia synaps chemicznych i obecności połączeń szczelinowych. Śledząc rozwój nerwów u pijawek z tłumioną ekspresją połączeń szczelinowych wykazano, że dwukierunkowe połączenie szczelinowe (elektryczna synapsa nerwów) musi utworzyć się między dwiema komórkami, zanim będą mogły rosnąć, tworząc jednokierunkową „chemiczną synapsę nerwów”. Synapsa nerwu chemicznego jest synapsą najczęściej skracaną do bardziej niejednoznacznego terminu „synapsa nerwu”.
Kompozycja
Connexins
Oczyszczanie łysinek międzykomórkowych połączeń szczelinowych wzbogaconych w białko tworzące kanały ( koneksynę ) wykazało w dyfrakcji rentgenowskiej heksagonalne macierze tworzące białko . Teraz możliwe stały się systematyczne badania i identyfikacja dominującego białka połączenia szczelinowego . Udoskonalone badania ultrastrukturalne przeprowadzone przez TEM wykazały, że białko występuje w sposób komplementarny w obu komórkach uczestniczących w blaszce połączeń szczelinowych. Blaszka połączenia szczelinowego jest stosunkowo dużym obszarem błony obserwowanym w cienkich przekrojach TEM i pęknięciu zamrożenia (FF) wypełnionym białkami przezbłonowymi w obu tkankach i łagodniej potraktowanych preparatach połączenia szczelinowego. Z widoczną zdolnością pojedynczego białka do umożliwienia komunikacji międzykomórkowej obserwowanej w połączeniach szczelinowych, termin połączenie szczelinowe miał tendencję do stawania się synonimem grupy połączonych koneksyn, chociaż nie wykazano tego in vivo. Analiza biochemiczna izolatów bogatych w złącza szczelinowe z różnych tkanek wykazała rodzinę koneksyn.
Ultrastruktura i biochemia izolowanych połączeń szczelinowych, o których już wspomniano, wskazały, że koneksyny preferencyjnie grupują się w blaszkach lub domenach połączeń szczelinowych, a koneksyny są najlepiej scharakteryzowanym składnikiem. Zauważono, że organizacja białek w macierze z blaszką szczelinową może być istotna. Prawdopodobnie ta wczesna praca już odzwierciedlała obecność czegoś więcej niż tylko koneksyn w połączeniach szczelinowych. Połączenie pojawiających się dziedzin zamrażania-złamań, aby zajrzeć do wnętrza błon i immunocytochemii w celu znakowania składników komórek (immunoznakowanie metodą zamrażania-złamania lub FRIL i immunoznakowanie cienkich przekrojów) wykazało, że blaszki połączeń szczelinowych in vivo zawierały białko koneksyny. Późniejsze badania z użyciem mikroskopii immunofluorescencyjnej większych obszarów tkanki wyjaśniły różnorodność wcześniejszych wyników. Potwierdzono, że łysinki połączenia przerwy mają zmienny skład, będąc domem dla białek koneksonu i nie-koneksyny, a także sprawiają, że współczesne użycie terminów „złącze przerwy” i „blaszka połączenia przerwy” są niewymienne. Innymi słowy, powszechnie stosowany termin „złącze szczelinowe” zawsze odnosi się do struktury, która zawiera koneksyny, podczas gdy płytka złącza szczelinowego może również zawierać inne cechy strukturalne, które ją definiują.
„Płytka” lub „płyta formacyjna”
Wczesne opisy „połączeń szczelinowych” i „koneksonów” nie odnosiły się do nich jako takich i stosowano wiele innych terminów. Jest prawdopodobne, że „dyski synaptyczne” były dokładnym odniesieniem do płytek połączeń szczelinowych. Podczas gdy szczegółowa struktura i funkcja koneksonu były wówczas opisane w ograniczony sposób, ogólna struktura „dysku” była stosunkowo duża i łatwo dostrzegalna za pomocą różnych technik TEM. Dyski umożliwiły naukowcom korzystającym z TEM łatwe zlokalizowanie koneksonów zawartych w dysku, takich jak łatki in vivo i in vitro. Dysk lub „płytka” wydawały się mieć inne właściwości strukturalne niż te nadawane przez same koneksony. Uważano, że jeśli obszar błony w blaszce przekazuje sygnały, obszar błony będzie musiał zostać w jakiś sposób uszczelniony, aby zapobiec wyciekowi. Późniejsze badania wykazały, że płytki połączenia szczelinowego są domem dla białek niebędących koneksynami, co sprawia, że współczesne użycie terminów „złącze przerwy” i „blaszka złącza przerwy” są niewymienne, ponieważ obszar płytki połączenia przerwy może zawierać białka inne niż koneksyny. Tak jak koneksyny nie zawsze zajmują całą powierzchnię blaszki, tak inne komponenty opisane w literaturze mogą być rezydentami długo- lub krótkoterminowymi.
Badania umożliwiające widok wewnątrz płaszczyzny błony skrzyżowania szczelin podczas formowania wskazuje, że „płytek amyloidu” utworzone pomiędzy dwoma komórek przed wymienionymi koneksyn porusza się. Były cząstek wolne obszary, gdy obserwowane przez TEM FF wskazując bardzo małe lub żadne białka transmembranowe są prawdopodobnie obecny. Niewiele wiadomo o tym, jakie struktury tworzą płytkę formacji lub jak zmienia się struktura płytki formacji, gdy koneksyny i inne składniki wchodzą lub wychodzą. Jedno z wcześniejszych badań nad powstawaniem małych połączeń szczelinowych opisuje rzędy cząstek i halo wolne od cząstek. Przy większych połączeniach szczelinowych opisywano je jako blaszki formacyjne z wnikającymi do nich koneksynami. Uważano, że połączenia szczelinowe tworzą się 4–6 godzin po pojawieniu się płytek formacji. W jaki sposób koneksyny mogą być transportowane do blaszek za pomocą tubuliny, staje się coraz jaśniejsze.
Płytka formująca i niekoneksynowa część klasycznej płytki nazębnej połączenia szczelinowego były trudne do przeanalizowania przez wczesnych badaczy. Wydaje się, że w TEM FF i cienkim przekroju jest domeną błony lipidowej, która może w jakiś sposób tworzyć stosunkowo sztywną barierę dla innych lipidów i białek. Istnieją pośrednie dowody na to, że pewne lipidy są preferencyjnie zaangażowane w tworzenie płytki nazębnej, ale nie można tego uznać za definitywny. Trudno jest przewidzieć rozerwanie błony w celu analizy blaszek błonowych bez wpływu na ich skład. Poprzez badanie koneksyn nadal w błonach zbadano lipidy związane z koneksynami. Stwierdzono, że określone koneksyny mają tendencję do preferencyjnego łączenia się z określonymi fosfolipidami. Ponieważ płytki formujące poprzedzają koneksyny, wyniki te nadal nie dają pewności co do tego, co jest wyjątkowe w składzie samych płytek. Inne odkrycia pokazują, że koneksyny łączą się z rusztowaniami białkowymi stosowanymi w innym połączeniu, zonula okludens ZO1 . Chociaż pomaga nam to zrozumieć, w jaki sposób koneksyny mogą być przenoszone do płytki tworzącej połączenie szczelinowe, skład samej płytki jest nadal nieco niepewny. Przy użyciu TEM FRIL poczyniono pewne postępy w zakresie składu płytki połączeń szczelinowych in vivo .
Zobacz też
Bibliografia
Dalsza lektura
- Harrisa, Andrzeja; Locke, Darren, wyd. (2009). Koneksyny . Nowy Jork: Springer. doi : 10.1007/978-1-59745-489-6 . Numer ISBN 978-1-934115-46-6.
Zewnętrzne linki
- Gap+Junctions w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)


