o -Toluidyna - o-Toluidine

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2-Metyloanilina |
|
| Inne nazwy
o- Metyloanilina
o- Toluidyna 1-Amino-2-metylobenzen 2-Aminotoluen |
|
| Identyfikatory | |
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.002.209 |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
| Nieruchomości | |
| C 7 H 9 N | |
| Masa cząsteczkowa | 107,156 g·mol -1 |
| Wygląd zewnętrzny | Bezbarwna ciecz |
| Zapach | Aromatyczny, anilinowy zapach |
| Gęstość | 1,004 g / cm 3 |
| Temperatura topnienia | -23,7 ° C (-10,7 ° F; 249,5 K) |
| Temperatura wrzenia | 200 do 202 °C (392 do 396 °F; 473 do 475 K) |
| 0,19 g/100 ml w 20 °C | |
| Ciśnienie pary | 0,307531 mmHg (25°C) |
| Zagrożenia | |
| Piktogramy GHS |
   
|
| Hasło ostrzegawcze GHS | Niebezpieczeństwo |
| H301 , H319 , H331 , H350 , H400 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301 + 310 , P304 + 340 , P305 + 351 + 338 , P308 + 313 , P311 , P321 , P330 , P337 + 313 , P391 , P403 + 233 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Temperatura zapłonu | 85 ° C (185° F; 358 K) |
| 481,67 ° C (899,01 ° F; 754.82 K) | |
| Dawka lub stężenie śmiertelne (LD, LC): | |
|
LD 50 ( mediana dawki )
|
900 mg/kg (szczur, doustnie) 323 mg/kg (królik, doustnie) |
| Związki pokrewne | |
|
Związki pokrewne
|
Toluidyna |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
| Referencje do infoboksu | |
O -Toluidine ( orto -toluidine ) jest związkiem organicznym o wzorze chemicznym CH 3 C 6 H 4 NH 2 . Jest to najważniejsza z trzech izomerycznych toluidyn . Jest to bezbarwna ciecz, chociaż próbki handlowe są często żółtawe. Jest prekursorem herbicydów metolachlor i acetochlor .
Synteza i reakcje
o- Toluidyna jest wytwarzana przemysłowo przez nitrowanie toluenu z wytworzeniem mieszaniny nitrotoluenów , faworyzującej izomer orto. Ta mieszanina jest oddzielana przez destylację. 2-Nitrotoluen uwodornia się z wytworzeniem o-toluidyny.
Konwersja o- toluidyny do soli diazoniowej daje dostęp do pochodnych 2-bromo, 2-cyjano- i 2-chlorotoluenu . Wykazano również N-acetylację.
Prilokaina , środek miejscowo znieczulający typu aminoamidowego , metabolizowana przez enzymy karboksyloesterazy daje o- toluidynę . Duże dawki prylokainy mogą powodować methemoglobinemię z powodu utleniania hemoglobiny przez o- toluidynę.
Metabolizm
Dystrybucja wchłaniania i wydalanie
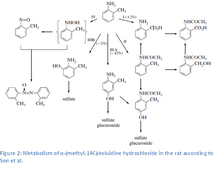
o -Toluidyna jest wchłaniana przez drogi oddechowe i przez kontakt ze skórą. Zaobserwowano intensywne wchłanianie o- toluidyny z przewodu pokarmowego . Główną drogą wydalania jest mocz, gdzie do jednej trzeciej podanego związku jest odzyskiwana w postaci niezmienionej. Główne metabolity 4-amino- m -krezolu i, w mniejszym stopniu, N -acetylo-4-amino- m -krezolu, azoxytoluene, O -nitrosotoluene, N -acetyl- O -toluidine, N -acetyl- O -aminobenzyl alkohol , kwas antranilowy, kwas N - acetyloantranilowy, 2-amino- m- krezol, p -hydroksy- o - toluidyna . Utworzone koniugaty były zdominowane przez koniugaty siarczanowe nad koniugatami glukuronidowymi w stosunku 6:1.
Metabolizm o- toluidyny obejmuje wiele konkurencyjnych szlaków aktywacji i dezaktywacji, w tym N - acetylację , N - oksydację i N - hydroksylację oraz utlenianie pierścienia. 4-hydroksylacja i N -acetylacja toluidyny to główne szlaki metaboliczne u szczurów. Podstawowy metabolizm o- toluidyny odbywa się w retikulum endoplazmatycznym . Ekspozycja na o- toluidynę zwiększa aktywność mikrosomalną hydroksylazy węglowodorów arylowych (szczególnie w nerkach), reduktazy NADPH-cytochromu c oraz zawartość cytochromu P-450. W wątrobie zachodzi N -hydroksylacja za pośrednictwem cytochromu P450 do N -hydroksy- o- toluidyny, rakotwórczego metabolitu. N- hydroksy- o- toluidyna może być metabolizowana do o- nitrozotoluenu lub sprzęgana z kwasem glukuronowym lub siarczanem i transportowana do pęcherza moczowego przez krew. Po dotarciu do pęcherza, N -hydroksy- o- toluidyna może zostać uwolniona z koniugatów w kwaśnym środowisku moczu, aby albo bezpośrednio reagować z DNA, albo być bioaktywowana poprzez siarczanowanie lub acetylowanie przez cytozolowe sulfotransferazy lub N- acetylotransferazy (przypuszczalnie NAT1). Postulowana forma aktywowana (na podstawie porównania z innymi aminami aromatycznymi), N- acetoksy- o- toluidyna, jest reaktywnym estrem, który tworzy elektrofilowe jony arylonitroniumowe, które mogą wiązać się z DNA . Inne szlaki aktywacji (szlaki utleniania pierścienia) amin aromatycznych obejmują reakcje katalizowane przez peroksydazę , które tworzą reaktywne metabolity (chinonoiminy utworzone z niesprzężonych metabolitów fenolowych) w pęcherzu. Te metabolity mogą wytwarzać reaktywne formy tlenu, powodując oksydacyjne uszkodzenie komórek i kompensacyjną proliferację komórek. Wsparcie dla tego mechanizmu pochodzi z badań oksydacyjnych uszkodzeń DNA indukowanych przez metabolity o-toluidyny w hodowanych komórkach ludzkich (HL-60), DNA grasicy cielęcej i fragmenty DNA z kluczowych genów, które uważa się za zaangażowane w karcynogenezę (c-Ha-ras onkogen i gen supresorowy nowotworu p53). Wspiera również ten mechanizm są obserwacje O -toluidine wywołanego uszkodzeniem DNA (część przerwy) w hodowanych ludzkich komórkach pęcherza i komórek pęcherza, szczurów i myszy, które w warunkach in vivo do O -toluidine.
Wiązanie hemoglobiny
Metabolity o- toluidyny wiążą hemoglobinę u szczurów. Uważa się, że istotnym metabolitem jest o- nitrozotoluen. co również powoduje raka pęcherza moczowego u szczurów. Nitrosotoluen przekształca hemoglobinę w methemoglobinę , powodując methemoglobinemię . Dowody sugerują, że ten szlak ma znaczenie dla ludzi.
Rakotwórczość
Chociaż mechanizmy rakotwórczości o-toluidyny nie są w pełni poznane, dostępne dowody sugerują, że są one złożone i obejmują kilka kluczowych sposobów działania, w tym aktywację metaboliczną, która powoduje wiązanie reaktywnych metabolitów z DNA i białkami, mutagenność , oksydacyjne uszkodzenia DNA , uszkodzenie chromosomów i cytotoksyczność .
W Stanach Zjednoczonych o- toluidyna została po raz pierwszy wymieniona w Trzecim Rocznym Raporcie o Substancjach Rakotwórczych jako „rozsądnie przewidywana jako czynnik rakotwórczy dla ludzi” w 1983 r., na podstawie wystarczających dowodów z badań na zwierzętach doświadczalnych. Raport w sprawie czynników rakotwórczych (ROC) jest US Kongres -mandated, oparte na nauce raport zdrowia publicznego, że agenci identyfikuje substancje, mieszaniny lub ekspozycje w środowisku, które stwarzają zagrożenie dla osób przebywających w Stanach Zjednoczonych Od tego czasu, inne nowotwory związane opublikowano badania, a wykaz o- toluidyny zmieniono na „znany jako czynnik rakotwórczy u ludzi”. o- toluidyna była szczególnie związana z rakiem pęcherza moczowego . Dokonano tego 31 lat później w trzynastym raporcie na temat czynników rakotwórczych (2014). Międzynarodowa Agencja Badań nad Rakiem (IARC) sklasyfikowała O -toluidine jako „rakotwórczy dla człowieka (grupa 1)”.
Toksykologia
Okazało się, że główna droga wydalania przebiega z moczem, gdzie do jednej trzeciej podanego związku jest odzyskiwana w postaci niezmienionej. o -toluidyna i jej metabolity wiążą się z hemoglobiną. O -toluidine metabolit O-nitrosotoluene, udowodniono, że powodują raka pęcherza u szczurów, i uważa się, że wiążą się z hemoglobiny u ludzi. o -Ekspozycja na toluidynę była badana w wielu różnych stopniach na zwierzętach.
Pojedyncza ekspozycja
O -Toluidine okazał się szkodliwy dla szczurów po ostrym względem doustnego podawania z LD 50 900 i 940 mg / kg masy ciała. Związek był również do niskiej toksyczności u królików po ekspozycji Ostra z LD 50 320 mg / kg masy ciała. Toksyczność po inhalacji nie została zidentyfikowana. Objawy po ostrym narażeniu to sinica (niebieskie lub fioletowe zabarwienie skóry z powodu niskiego nasycenia tlenem w tkance), podwyższony poziom methemoglobiny oraz umiarkowane podrażnienie skóry i ciężkie podrażnienie oczu u królików.
Ekspozycja krótkoterminowa
Badano jedynie krótkotrwałą ekspozycję doustną szczurów na o- toluidynę. Ekspozycja skórna wpłynęła na cykl jajnikowy, morfostrukturę jajników, zdolność do reprodukcji i potomstwo samic szczurów przy podawaniu przez cztery miesiące (Malysheva i Zaitseva, 1982). Samce szczurów traktowane podobnie wykazywały stymulowaną spermatogenezę (produkcję plemników) (Malysheva i wsp., 1983). Narażenie inhalacyjne nie zostało zidentyfikowane. Szczurom podawano związek w dawce 1125 mg/kg masy ciała przez pięć dni (225 mg/kg masy ciała na dzień). Obserwowane objawy obejmowały podwyższony poziom methemoglobiny, przekrwienie, hemosyderozę (zaburzenie przeładowania żelazem), hematopoezę (tworzenie składników komórkowych krwi) w śledzionie i 1,5 do 3,0-krotny wzrost masy śledziony.
Chroniczna ekspozycja
Przewlekła doustna ekspozycja na chlorowodorek o- toluidyny wywołała zwiększoną częstość występowania nowotworów (łagodnych i złośliwych) u szczurów i myszy. W jednym badaniu szczurom podawano dawki około 150 i 300 mg/kg masy ciała (niska i wysoka dawka), obecna była również grupa kontrolna (NCI, 1979; Goodman i wsp., 1984). Ekspozycja była związana z zależnym od dawki zmniejszeniem przyrostu masy ciała, skróceniem przeżycia i zwiększoną częstością występowania wielu rodzajów raka ( mięsaki , naczyniakomięsaki , włókniakomięsaki , kostniakomięsaki , włókniaki , gruczolakowłókniaki i międzybłoniaki ). Zaobserwowano również efekty nienowotworowe. Obejmowały one rozrost (nieprawidłowy wzrost objętości tkanki), zwłóknienie (powstawanie nadmiaru włóknistej tkanki łącznej) i martwicę wątroby (przedwczesna śmierć komórek w żywej tkance). Wiele innych badań, w których szczurom lub myszom podawano o- toluidynę przez dłuższy czas, dało podobne wyniki, w tym między innymi zmniejszenie przeżywalności i zwiększoną częstość występowania różnych typów raka (Hecht i in., 1982; Weisburger i in. ., 1978; NCI, 1979; Weisburger i in., 1978).
Narażenie ludzi
Ostra ekspozycja człowieka na o- toluidynę może powodować bolesny krwiomocz (obecność czerwonych krwinek w moczu) (Goldbarb i Finelli, 1974). Przewlekłe narażenie ludzi na o- toluidynę obserwowano również w wielu retrospektywnych badaniach kohortowych w przemyśle barwników . Wyniki obejmują zwiększoną częstość zgonów i zwiększoną zachorowalność na raka pęcherza . Jednak ostateczne powiązanie ich z o- toluidyną okazało się trudne ze względu na narażenie na inne spodziewane związki rakotwórcze w przemyśle barwników. Jedno z badań oceniało zwiększoną zachorowalność na śmiertelność i raka pęcherza moczowego u 906 pracodawców w fabryce barwników w północnych Włoszech w średnim okresie utajonym 25 lat. Śmiertelność z powodu raka pęcherza była znacznie wyższa u pracodawców niż osób narażonych tylko na określone chemikalia obecne w fabryce, w użyciu lub przerywanym kontakcie. o -Stwierdzono, że toluidyna prawie na pewno może powodować raka pęcherza u mężczyzn.
Inny rejestrator badań spodziewał się i obserwował przypadki raka pęcherza moczowego w fabryce gumy w północnej części stanu Nowy Jork (Ward i in., 1991). W badaniu oceniono 1749 pracowników płci męskiej i żeńskiej w okresie 15 lat. Ekspozycja dotyczyła głównie o- toluidyny i aniliny i zaobserwowano znaczny wzrost zachorowalności na raka pęcherza moczowego. Jednak rakotwórczości nie można było ostatecznie przypisać o- toluidynie. Inne badania obejmują Vigliani i Barsotti (1961), Khlebnikova i in. (1970), Zavon i in. (1973), Conso i Pontal (1982) oraz Rubino i in. (1982).
Specyficzne mechanizmy rakotwórczości o- toluidyny nie są w pełni poznane, ale wiadomo, że są złożone i obejmują aktywację metaboliczną, która powoduje powstawanie reaktywnych metabolitów. Przykładem tych reaktywnych metabolitów jest wspomniany wcześniej o- nitrozotoluen, który powoduje raka u szczurów. Badania wykazały, że o- toluidyna jest mutagenem i powoduje oksydacyjne uszkodzenia DNA i uszkodzenia chromosomów (Skipper et al. 2010). Wiele badań wykazało, że związek indukuje oksydacyjne uszkodzenia DNA i pęknięcia nici w hodowanych komórkach ludzkich (Watanabe i wsp. 2010; Ohkuma i wsp. 1999, Watanabe i wsp. 2010). Uszkodzenie DNA zaobserwowano również u szczurów i myszy wystawionych in vivo na o- toluidynę (Robbiano i wsp. 2002, Sekihashi i wsp. 2002), a nawet uszkodzenia chromosomów na dużą skalę zaobserwowano w komórkach drożdży i ssaków wystawionych na działanie o- toluidyny in vitro. Mówiąc ogólniej, wiadomo, że niestabilność chromosomowa jest indukowana przez aminy aromatyczne w komórkach pęcherza moczowego. Niestabilność chromosomowa może prowadzić zarówno do aneuploidii (obecność nieprawidłowej liczby chromosomów w komórce), obserwowanej w komórkach nowotworowych, jak i utraty heterozygotyczności (utrata całego genu i otaczającego go regionu chromosomowego), co może skutkować brakiem genu supresorowego nowotworu (Höglund i wsp. 2001, Sandberg 2002, Phillips i Richardson 2006).
Specyficzne oznaczanie glukozy
o- Toluidyna może być również stosowana do pomiaru stężenia glukozy w surowicy w postaci kwasu octowego – o- toluidyny. W latach 70. ogromną popularność zyskała reakcja o- toluidynowa służąca do oznaczania stężenia glukozy w surowicy. Ta metoda była najczęściej stosowana przez laboratoria kliniczne. Ze względu na potencjalne zagrożenie dla zdrowia laboratoria dysponują obecnie zmodyfikowaną metodą, wykorzystując alternatywne związki.