Proteinoza pęcherzyków płucnych - Pulmonary alveolar proteinosis
| Proteinoza pęcherzyków płucnych | |
|---|---|
| Inne nazwy | proteinoza pęcherzykowa |
 | |
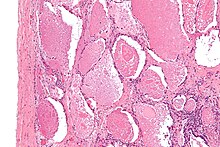
| Mikrografia proteinozy pęcherzyków płucnych, ukazująca charakterystyczne wypełnienie przestrzeni powietrznej ogniskowo gęstymi kulkami określanymi jako drgania lub ciała gęste . Bejca H&E . | |
| Specjalność |
Pulmonologia |
Proteinoza pęcherzyków płucnych ( PAP ) jest rzadką chorobą płuc charakteryzującą się nieprawidłową akumulacją związków lipoprotein pochodzących z surfaktantów w pęcherzykach płucnych. Nagromadzone substancje zakłócają normalną wymianę gazową i rozszerzanie się płuc, ostatecznie prowadząc do trudności w oddychaniu i predyspozycji do rozwoju infekcji płuc. Przyczyny PAP można podzielić na pierwotne (autoimmunologiczny PAP, dziedziczny PAP), wtórne (choroby mnogie) i wrodzone (choroby mnogie, zwykle genetyczne), chociaż najczęstszą przyczyną jest pierwotna choroba autoimmunologiczna u osobnika.
Symptomy i objawy
Oznaki i objawy PAP obejmują duszność , jak kaszel , niskiej klasy gorączka i utrata masy ciała . Dodatkowo przebieg kliniczny PAP jest nieprzewidywalny. Uznaje się spontaniczną remisję , a niektórzy pacjenci mają stabilne objawy. Śmierć może nastąpić z powodu progresji PAP lub jakiejkolwiek choroby towarzyszącej. Osoby z PAP są bardziej podatne na infekcje płuc, takie jak bakteryjne zapalenie płuc , zakażenie prątkami avium-intracellulare lub zakażenie grzybicze .
Powoduje
Nieprawidłowa akumulacja związków lipoproteinowych w PAP jest spowodowana zaburzeniami regulacji i klirensu surfaktantów. Jest to zwykle związane z upośledzoną funkcją makrofagów pęcherzykowych. U dorosłych najczęstszą przyczyną PAP jest autoimmunizacja na czynnik stymulujący tworzenie kolonii granulocytów i makrofagów (GM-CSF), czynnik krytyczny w rozwoju makrofagów pęcherzykowych. Zmniejszona biodostępność GM-CSF skutkuje słabym rozwojem i funkcją makrofagów pęcherzykowych, co skutkuje akumulacją surfaktanta i produktów pokrewnych.
Wtórnymi przyczynami PAP są te, w których nagromadzenie związków lipoproteinowych jest wtórne do innego procesu chorobowego. Zostało to rozpoznane w przypadku niektórych nowotworów (takich jak białaczka szpikowa ), infekcji płuc lub narażenia środowiska na pyły lub chemikalia , takie jak nikiel.
Chociaż przyczyna PAP nie była pierwotnie rozumiana, głównym przełomem w zrozumieniu przyczyny choroby była przypadkowa obserwacja, że myszy hodowane do badań eksperymentalnych bez hematologicznego czynnika wzrostu znanego jako czynnik stymulujący tworzenie kolonii granulocytów i makrofagów (GM- CSF) rozwinął zespół płucny nieprawidłowej akumulacji surfaktanta, przypominający ludzki PAP.
Konsekwencje tego odkrycia są nadal badane, ale znaczny postęp odnotowano w lutym 2007 r. Badacze w tym raporcie omówili obecność autoprzeciwciał anty -GM-CSF u pacjentów z PAP i powielili ten zespół poprzez wlew tych autoprzeciwciał myszom .
Rodzinne lub sporadyczne mutacje inaktywujące w jednym z dwóch macierzystych genów GATA2 powodują autosomalne dominujące zaburzenie zwane niedoborem GATA2 . GATA2 gen wytwarza GATA2 czynnik transkrypcyjny , który jest istotny dla rozwoju embrionalnego , konserwacji i funkcjonalności krwiotwórczych , lympathic formowania i innych komórek tworzących tkanki. Osoby z pojedynczą mutacją inaktywującą GATA2 cierpią na szeroki zakres zaburzeń, w tym proteinozę pęcherzyków płucnych. Oparta na mutacji GATA2 proteinoza pęcherzyków płucnych jest związana z normalnym poziomem GM-CSF i zwykle poprawia się lub jej unika się u osób dotkniętych chorobą, które z powodzeniem przeszły przeszczep krwiotwórczych komórek macierzystych .
Genetyka
Dziedziczna proteinoza pęcherzyków płucnych jest recesywną chorobą genetyczną, w której rodzą się osoby z mutacjami genetycznymi, które pogarszają funkcję receptora alfa CSF2 na makrofagach pęcherzykowych. W konsekwencji cząsteczka przekaźnikowa znana jako czynnik stymulujący tworzenie kolonii granulocytów/makrofagów (GM-CSF) nie jest w stanie stymulować makrofagów pęcherzykowych do usuwania środka powierzchniowo czynnego, co prowadzi do trudności w oddychaniu. Gen receptora alfa CSF2 znajduje się w regionie 5q31 chromosomu 5, a produkt genu można również określić jako receptor czynnika stymulującego tworzenie kolonii granulocytów i makrofagów.
Diagnoza
Diagnoza PAP jest wykonany przy użyciu kombinacji objawów danej osoby, obrazowanie piersi i mikroskopowej oceny płuc prania / tkanki . Pomocne w potwierdzeniu są dodatkowe testy na obecność przeciwciał anty-GM-CSF w surowicy.
Chociaż zarówno objawy, jak i wyniki badań obrazowych są stereotypowe i dobrze opisane, są niespecyficzne i nie do odróżnienia od wielu innych schorzeń. Na przykład prześwietlenie klatki piersiowej może wykazywać zmętnienia pęcherzyków, a tomografia komputerowa może wykazywać szalony wzór brukujący płuca , które są obserwowane częściej w wielu innych stanach. Tak więc diagnoza zależy przede wszystkim od ustaleń patologicznych.
Popłuczyny z płuc lub tkanki do analizy histopatologicznej są najczęściej uzyskiwane za pomocą płukania oskrzelowo-pęcherzykowego i/lub biopsji płuc. Charakterystyczne wyniki biopsji wskazują na wypełnienie pęcherzyków (czasem terminalnych oskrzelików) amorficznym materiałem eozynofilowym, który wybarwia się silnie dodatnio w barwieniu PAS i PAS diastazie . Otaczające pęcherzyki płucne i śródmiąższowe płuca pozostają względnie prawidłowe. Mikroskopia elektronowa próbki, chociaż zwykle nie jest wykonywana z powodu niepraktyczności, pokazuje ciała lamelowane reprezentujące środek powierzchniowo czynny. Alternatywnym rozpoznaniem z podobnymi wynikami histomorfologicznymi jest zapalenie płuc wywołane przez Pneumocystis jirovicii .
Popłuczyny z płuc w charakterystyczny sposób dają płyn, który ma „mleczną” kompozycję. Pod mikroskopem próbki pokazują 20-50 mikrometrów PAS-dodatnich kuleczek na tle drobnoziarnistego lub amorficznego materiału PAS-dodatniego. Zazwyczaj występuje niewielka liczba makrofagów i komórek zapalnych (chociaż jest to zmienne).
Leczenie
Standardowym leczeniem PAP jest płukanie całego płuca i leczenie podtrzymujące. Płukanie całych płuc to zabieg wykonywany w znieczuleniu ogólnym, podczas którego jedno płuco jest przepompowywane tlenem (płuco wentylowane), a drugie płuco (płuco niewentylowane) napełniane jest ciepłym roztworem soli fizjologicznej (do 20 l) i drenowane, usuwanie wraz z nim wszelkich ścieków białkowych. Jest to ogólnie skuteczne w łagodzeniu objawów PAP, często przez dłuższy czas. Inne metody leczenia, które są nadal badane, obejmują podskórny i wziewny GM-CSF oraz rytuksymab, wlew dożylny, który hamuje wytwarzanie autoprzeciwciał odpowiedzialnych za autoimmunologiczny PAP. Przeszczepienie płuc wykonano u osób z różnymi postaciami PAP; jednak jest to często stosowane tylko wtedy, gdy wszystkie inne opcje leczenia zawiodły i doszło do znacznego uszkodzenia płuc z powodu ryzyka, powikłań lub nawrotu PAP po przeszczepie.
Epidemiologia
Choroba występuje częściej u mężczyzn i palaczy tytoniu .
W niedawnym badaniu epidemiologicznym z Japonii autoimmunologiczny PAP ma częstość występowania i częstość występowania wyższą niż wcześniej zgłoszono i nie jest silnie powiązany z paleniem, narażeniem zawodowym lub innymi chorobami. Endogenne lipidowe zapalenie płuc i nieswoiste śródmiąższowe zapalenie płuc obserwowano przed rozwojem PAP u dziecka.
Historia
PAP został po raz pierwszy opisany w 1958 roku przez lekarzy Samuela Rosena, Benjamina Castlemana i Averilla Liebowa . W swojej serii przypadków opublikowanej w New England Journal of Medicine 7 czerwca tego roku opisali 27 pacjentów z patologicznymi dowodami na obecność materiału Schiff-dodatnich kwasu nadjodowego wypełniającego pęcherzyki. Ten bogaty w lipidy materiał został następnie uznany za środek powierzchniowo czynny.
Opisane leczenie PAP z zastosowaniem terapeutycznego płukania oskrzelowo-pęcherzykowego przeprowadził w 1960 r. dr Jose Ramirez-Rivera ze Szpitala Administracyjnego Weteranów w Baltimore, który opisał powtarzające się „zalewania segmentowe” jako sposób fizycznego usunięcia nagromadzonego materiału pęcherzykowego.
Badania
PAP jest jedną z rzadkich chorób płuc, które są obecnie badane przez Konsorcjum Rare Lung Diseases Consortium. Konsorcjum jest częścią Sieci Badań Klinicznych Chorób Rzadkich , inicjatywy Biura Badań nad Chorobami Rzadkimi Narodowego Centrum Zaawansowanych Nauk Translacyjnych i poświęconej opracowywaniu nowej diagnostyki i terapii dla pacjentów z rzadkimi chorobami płuc, poprzez współpracę między Narodowe Instytuty Zdrowia , organizacje pacjentów i badacze kliniczni.
Bibliografia
Zewnętrzne linki
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |