Tiwozanib - Tivozanib
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Fotivda |
| Inne nazwy | AV-951 |
| AHFS / Drugs.com | Fotivda |
| Dane licencyjne | |
| Drogi administracji |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Wiązanie białek | >99% |
| Okres półtrwania eliminacji | 4,5-5,1 dni |
| Wydalanie | 79% kał , 12% mocz |
| Identyfikatory | |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
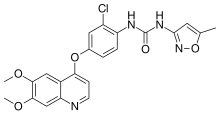
| Formuła | C 22 H 19 Cl N 4 O 5 |
| Masa cząsteczkowa | 454,87 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Tiwozanib , sprzedawany pod marką Fotivda , jest lekiem stosowanym w leczeniu nawrotowego lub opornego na leczenie zaawansowanego raka nerkowokomórkowego (RCC). Jest to doustny inhibitor kinazy tyrozynowej receptora VEGF .
Najczęstsze działania niepożądane to zmęczenie, nadciśnienie, biegunka, zmniejszony apetyt, nudności, dysfonia, niedoczynność tarczycy, kaszel i zapalenie jamy ustnej.
Tiwozanib został dopuszczony do użytku medycznego w Unii Europejskiej w sierpniu 2017 r., a w Stanach Zjednoczonych w marcu 2021 r.
Zastosowania medyczne
Tiwozanib stosuje się w leczeniu dorosłych z nawrotowym lub opornym na leczenie zaawansowanym rakiem nerkowokomórkowym (RCC) po dwóch lub więcej wcześniejszych terapiach ogólnoustrojowych.
Przeciwwskazania
Tiwozanibu nie wolno łączyć z dziurawcem zwyczajnym , induktorem enzymu wątrobowego CYP3A4 (patrz interakcje poniżej). Nie należy go stosować w czasie ciąży, ponieważ ma działanie teratogenne , embriotoksyczne i fetotoksyczne u szczurów.
Niekorzystne skutki
Najczęstszymi działaniami niepożądanymi w badaniach były nadciśnienie (wysokie ciśnienie krwi, u 48% pacjentów), dysfonia (chrypka, 27%), zmęczenie i biegunka (oba 26%). Przełom nadciśnieniowy wystąpił u 1% pacjentów.
Interakcje
Podanie pojedynczej dawki tiwozanibu z ryfampicyną , silnym induktorem enzymu CYP3A4, skraca biologiczny okres półtrwania i całkowitą ekspozycję ( AUC ) tiwozanibu o połowę, ale nie ma istotnego wpływu na najwyższe stężenia we krwi. Skojarzenie z ketokonazolem , silnym inhibitorem CYP3A4, nie ma istotnego wpływu. Kliniczne znaczenie tych wyników nie jest znane.
Farmakologia
Mechanizm akcji
Chinoliny mocznik pochodną tivozanib tłumi rozwój naczyń przez są selektywnie hamujące wobec czynnika wzrostu śródbłonka naczyniowego (VEGF). Jest przeznaczony do hamowania wszystkich trzech receptorów VEGF.
Farmakokinetyka
Po doustnym przyjęciu tiwozanibu najwyższe stężenia w surowicy krwi osiągane są po 2 do 24 godzinach. Całkowite AUC jest niezależne od spożycia pokarmu. W krwiobiegu ponad 99% substancji wiąże się z białkami osocza , głównie albuminami . Chociaż enzymy CYP3A4 i CYP1A1 oraz kilka UGT są zdolne do metabolizowania leku, ponad 90% krąży w postaci niezmienionej. Metabolity to produkty demetylacji , hydroksylacji i N- oksydacji oraz glukuronidy .
Biologiczny okres półtrwania wynosi 4,5 do 5,1 dni; 79% jest wydalane z kałem , głównie w postaci niezmienionej, a 12% z moczem, całkowicie niezmienione.
Chemia
Tiwozanib jest stosowany w postaci jednowodnego chlorowodorku , który jest proszkiem o barwie od białej do jasnobrązowej. Jest praktycznie nierozpuszczalny w wodzie i słabo rozpuszczalny w wodnych kwasach, etanolu i metanolu . Nie jest higroskopijny i nieaktywny optycznie .
Historia
Został odkryty przez Kyowa Kirin i opracowany przez AVEO Pharmaceuticals .
Badania kliniczne
Wyniki III fazy dotyczące zaawansowanego raka nerkowokomórkowego sugerowały poprawę mediany przeżycia wolnego od progresji o 30% lub 3 miesiące w porównaniu z sorafenibem, ale wykazały gorszy wskaźnik przeżycia całkowitego w ramieniu eksperymentalnym w porównaniu z ramieniem kontrolnym. Food and Drug Administration „s Komitet Doradczy onkologicznych Leki głosowało 13 maja 2013 do 1 na rekomendowanie zatwierdzenia tivozanib na raka nerki. Komitet uznał, że lek nie wykazał korzystnego stosunku ryzyka do korzyści i zakwestionował równość projektu badania, który umożliwił pacjentom z grupy kontrolnej, którzy stosowali sorafenib, przejście na tiwozanib po wystąpieniu choroby progresywnej, ale nie tym, którzy w ramieniu eksperymentalnym stosowali tiwozanib, aby przejść na leczenie tiwozanibem. sorafenib . Wniosek został formalnie odrzucony przez FDA w czerwcu 2013 roku, mówiąc, że zatwierdzenie będzie wymagać dodatkowych badań klinicznych.
W 2016 r. AVEO Oncology opublikowało dane w połączeniu ze spotkaniem ASCO, pokazujące wpływ położenia geograficznego na całkowite przeżycie w badaniu fazy III.
W 2016 r. AVEO Oncology ogłosiło rozpoczęcie drugiego badania klinicznego III fazy z udziałem pacjentów z zaawansowanym RCC trzeciej linii.
W 2016 r. EUSA Pharma i AVEO Oncology ogłosiły, że tiwozanib został przedłożony do oceny Europejskiej Agencji Leków w ramach procedury scentralizowanej.
W czerwcu 2017 r. Komitet Naukowy EMA zarekomendował tiwozanib do zatwierdzenia w Europie, a zatwierdzenie spodziewane jest we wrześniu.
W sierpniu 2017 r. Komisja Europejska (KE) formalnie zatwierdziła tiwozanib w Europie.
Bibliografia
Zewnętrzne linki
- „Tiwozanib” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
