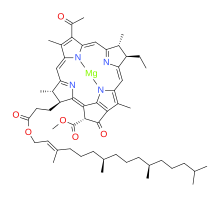
Chlorofilid - Chlorophyllide
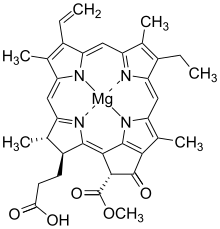 Chlorofilid a
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Magnez (3 S , 4 S , 21 R ) -3- (2-karboksyetylo) -14-etylo-21- (metoksykarbonylo) -4,8,13,18-tetrametylo-20-okso-9-winylo-23, 25-didehydroforbino-23,25-diid
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Nieruchomości | |
| C 35 H 34 MgN 4 O 5 | |
| Masa cząsteczkowa | 614,973 g / mol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|
| Referencje Infobox | |
Chlorofilid a i chlorofilid b są biosyntetycznymi prekursorami odpowiednio chlorofilu a i chlorofilu b . Ich grupy kwasu propionowego są przekształcane w estry fytylowe przez enzym syntazę chlorofilową na ostatnim etapie szlaku. Stąd głównym zainteresowaniem tymi związkami chemicznymi były badania biosyntezy chlorofilu u roślin , alg i cyjanobakterii . Chlorofilid a jest również półproduktem w biosyntezie bakteriochlorofilów .
Struktury
Chlorofilid a jest kwasem karboksylowym (R = H). W chlorofilidzie b , grupa metylowa w pozycji 13 ( numeracja IUPAC dla chlorofilidu a ) i wyróżniona w zielonym polu jest zastąpiona grupą formylową .
Biosynteza prowadzi do powstania protoporfiryny IX
We wczesnych etapach biosyntezy, która rozpoczyna się od kwasu glutaminowego , tetrapirol jest tworzony przez enzymy deaminazę i kosyntetazę, które przekształcają kwas aminolewulinowy poprzez porfobilinogen i hydroksymetylbilan w uroporfirynogen III . Ten ostatni jest pierwszym makrocyklicznym związkiem pośrednim wspólnym dla hemu , sirohaemu , kofaktora F 430 , kobalaminy i samego chlorofilu. Kolejnymi związkami pośrednimi są koproporfirynogen III i protoporfirynogen IX , który jest utleniany do w pełni aromatycznej protoporfiryny IX . Wprowadzenie żelaza do protoporfiryny IX na przykład u ssaków daje hem, kofaktor przenoszący tlen we krwi, ale zamiast tego rośliny łączą magnez, aby po dalszych przemianach otrzymać chlorofil do fotosyntezy.
Biosynteza chlorofilidów z protoporfiryny IX
Szczegóły późnych etapów biosyntetycznego szlaku do chlorofilu różnią się w zależności od roślin (na przykład Arabidopsis thaliana , Nicotiana tabacum i Triticum aestivum ) i bakterii (na przykład Rubrivivax gelatinosus i Synechocystis ), u których był badany. Jednak chociaż geny i enzymy różnią się, zachodzące reakcje chemiczne są identyczne.
Wprowadzenie magnezu
Chlorofil charakteryzuje się koordynacją jonu magnezu w ligandzie zwanym chlorem . Metal jest wprowadzany do protoporfiryny IX przez enzym chelatazę magnezu, który katalizuje reakcję EC 6.6.1.1
Estryfikacja grupy propionianowej pierścienia C.
Kolejnym krokiem w kierunku chlorofilidów jest utworzenie estru metylowego (CH 3 ) na jednej z grup propionianowych, który jest katalizowany przez enzym metylotransferazę protoporfiryny IX magnezu w reakcji metylacji EC 2.1.1.11
- Protoporfiryna IX + S-adenozylometionina Ester 13-metylowy protoporfiryny IX + S-adenozylo-L-homocysteina
Od porfiryny do chloru
Układ pierścieni chloru zawiera pięcioczłonowy pierścień węglowy E powstaje, gdy jedna z grup propionianowych porfiryny jest cyklizowana do atomu węgla łączącego oryginalne pierścienie pirolowe C i D.Seria etapów chemicznych katalizowanych przez enzym protoporfirynę magnezu IX cyklazy estru monometylowego (oksydacyjnego) daje ogólną reakcję EC 1.14.13.81
- Ester 13-monometylowy protoporfiryny IX + 3 NADPH + 3 H + + 3 O 2 diwinyloprotochlorofilid + 3 NADP + + 5 H 2 O
W jęczmieniu elektrony są dostarczane przez zredukowaną ferredoksynę , która może je otrzymać z fotosystemu I lub, w ciemności, z reduktazy Ferredoxin -NADP (+) : białko cyklazy nazywa się XanL i jest kodowane przez gen Xantha-1 . W organizmach beztlenowych, takich jak Rhodobacter sphaeroides, zachodzi ta sama ogólna przemiana, ale tlen włączony do estru 13-monometylowego protoporfiryny IX magnezu pochodzi z wody w reakcji EC 1.21.98.3 .
Etapy redukcji do chlorofilidu a
Do wytworzenia chlorofilidu a wymagane są dwie dalsze transformacje . Zarówno to zmniejszenie reakcji: jedna przekształca grupę winylową An etyl , a drugi dodanie dwóch atomów wodoru do pierścienia pirolowego D, chociaż całkowita aromatyczności makrocyklu jest zachowana. Reakcje te przebiegają niezależnie, aw niektórych organizmach kolejność jest odwrotna. Enzym diwinylochlorofilid a 8-winylo-reduktaza przekształca 3,8-diwinyloprotochlorofilid w protochlorofilid w reakcji EC 1.3.1.75
- 3,8-diwinyloprotochlorofilid + NADPH + H + protochlorofilid + NADP +
Następnie następuje reakcja EC 1.3.1.33, w której pierścień pirolowy D jest redukowany przez enzym reduktazę protochlorofilidu
- protochlorofilid + NADPH + H + chlorofilid a + NADP +
Ta reakcja jest zależna od światła, ale istnieje alternatywny enzym, Ferredoksyna: reduktaza protochlorofilidu (zależna od ATP) , który wykorzystuje zredukowaną ferredoksynę jako kofaktor i nie jest zależny od światła; wykonuje podobną reakcję EC 1.3.7.7, ale z alternatywnym substratem 3,8-diwinyloprotochlorofilidem
- 3,8-divinylprotochlorophyllide zredukowana ferredoksyna + ATP + 2 + 2 H 2 O 3,8-divinylchlorophyllide + utlenione ferredoksyna ADP + 2 + 2 fosforan
W organizmach, które stosują tę alternatywną sekwencję etapów redukcji, proces kończy się reakcją EC 1.3.7.13 katalizowaną przez enzym, który może pobierać różne substraty i przeprowadzać wymaganą redukcję grup winylowych, na przykład w tym przypadku
- 3,8-diwinylochlorofilid a + 2 zredukowana ferredoksyna + 2 H + chlorofilid a + 2 utleniona ferredoksyna
Od chlorofilidu a do chlorofilidu b
Chlorofilid a oksygenaza jest enzymem, który przekształca chlorofilid a w chlorofilid b poprzez katalizowanie całej reakcji EC 1.3.7.13
- chlorofilid a + 2 O 2 + 2 NADPH + 2 H + chlorofilid b + 3 H 2 O + 2 NADP +
Zastosowanie w biosyntezie chlorofilu a i chlorofilu b
Syntaza chlorofilu kończy biosyntezę chlorofilu a poprzez katalizowanie reakcji EC 2.5.1.62
- chlorofilid a + difosforan fytylu chlorofil a + difosforan
To tworzy ester z grupą kwasu karboksylowego na chlorophyllide A z 20 węgla diterpenem alkoholu fitol . Chlorofil b jest wytwarzany przez ten sam enzym działający na chlorofilid b .
Zastosowanie w biosyntezie bakteriochlorofilów
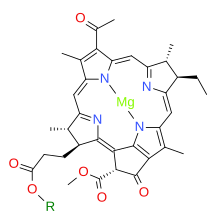
Bakteriochlorofile to zbierające światło pigmenty występujące w bakteriach fotosyntetyzujących: nie wytwarzają tlenu jako produktu ubocznego. Istnieje wiele takich struktur, ale wszystkie są biosyntetycznie powiązane, ponieważ pochodzą od chlorofilidu a . Typowym przykładem jest bakteriochlorofil a ; jego biosyntezę badano na Rhodobacter capsulatus i Rhodobacter sphaeroides .
Pierwszym krokiem jest redukcja (za pomocą stereochemii trans ) pierścienia pirolowego B, dając charakterystyczny 18-elektronowy układ aromatyczny wielu bakteriochlorofilów. Dokonuje tego enzym chlorofilid a reduktaza , który katalizuje reakcję EC 1.3.7.15 .
- chlorofilid a + 2 zredukowana ferredoksyna + ATP + H 2 O + 2 H + 3-winylobakteriochlorofilid 3-deacetylo a + 2 utleniona ferredoksyna + ADP + fosforan
Kolejne dwa etapy przekształcają grupę winylową najpierw w grupę 1-hydroksyetylową, a następnie w grupę acetylową bakteriochlorofilidu a . Reakcje są katalizowane przez chlorofilid a 3 1- hydratazę ( EC 4.2.1.165 ) i bakteriochlorofilid dehydrogenazę ( EC 1.1.1.396 ) w następujący sposób:
- 3-deacetylo 3-winylobakteriochlorofilid a + H 2 O 3-deacetylo 3- (1-hydroksyetylo) bakteriochlorofilid a
- 3- (1-hydroksyetylo) bakteriochlorofilid 3-deacetylu a + NAD + bakteriochlorofilid a + NADH + H +
Te trzy reakcje katalizowane enzymatycznie mogą wystąpić w różnej kolejności w celu wytworzenia bacteriochlorophyllide gotowy do estryfikacji końcowym pigmentów fotosyntezy. Ester fytylowy bakteriochlorofilu a nie jest przyłączony bezpośrednio: raczej początkowym związkiem pośrednim jest ester z R = geranylogeranylem (z pirofosforanu geranylogeranylu ), który następnie poddaje się dodatkowym etapom, gdy trzy wiązania alkenowe łańcucha bocznego są redukowane.