Mupirocyna - Mupirocin
 | |
 Kwas pseudomonowy A (PA-A), główny składnik mupirocyny
| |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Bactroban, inne |
| Inne nazwy | mucyprocyna |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a688004 |
| Dane licencyjne | |
Kategoria ciąży |
|
| Drogi administracji |
Aktualny |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Wiązanie białek | 97% |
| Okres półtrwania eliminacji | 20 do 40 minut |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CZEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.106.215 |
| Dane chemiczne i fizyczne | |
| Formuła | C 26 H 44 O 9 |
| Masa cząsteczkowa | 500,629 g·mol -1 |
| Model 3D ( JSmol ) | |
| Temperatura topnienia | 77 do 78 ° C (171 do 172 ° F) |
| |
| |
|
| |
Mupirocyna , sprzedawana między innymi pod marką Bactroban , jest miejscowym antybiotykiem przydatnym w powierzchownych infekcjach skóry, takich jak liszajec czy zapalenie mieszków włosowych . Może być również stosowany do pozbycia się opornego na metycylinę gronkowca złocistego (MRSA), gdy jest obecny w nosie bez objawów. Ze względu na obawy dotyczące rozwoju odporności nie zaleca się stosowania dłużej niż dziesięć dni. Stosuje się go jako krem lub maść nakładaną na skórę.
Częste działania niepożądane to swędzenie i wysypka w miejscu aplikacji, ból głowy i nudności. Długotrwałe stosowanie może spowodować wzmożony rozwój grzybów . Stosowanie w czasie ciąży i karmienia piersią wydaje się być bezpieczne. Mupirocyna należy do klasy leków zawierających kwasy karboksylowe . Działa poprzez blokowanie zdolności bakterii do wytwarzania białka, co zwykle prowadzi do śmierci bakterii .
Mupirocyna została początkowo wyizolowana w 1971 z Pseudomonas fluorescens . Znajduje się na Liście Leków Podstawowych Światowej Organizacji Zdrowia . W 2018 roku był to 165. najczęściej przepisywany lek w Stanach Zjednoczonych, z ponad 3 milionami recept.
Zastosowania medyczne
Mupirocyna jest stosowana do miejscowego leczenia bakteryjnych infekcji skóry, na przykład czyrak , liszajec , otwarte rany, które są zwykle spowodowane zakażeniem przez Staphylococcus aureus lub Streptococcus pyogenes . Jest również przydatny w leczeniu powierzchownych zakażeń gronkowcem złocistym (MRSA) opornym na metycylinę . Mupirocyna jest nieaktywna dla większości bakterii beztlenowych, prątków, mykoplazm, chlamydii, drożdży i grzybów.
Donosowa mupirocyna przed zabiegiem chirurgicznym jest skuteczna w zapobieganiu pooperacyjnemu zakażeniu rany Staphylcoccus aureus, a zapobiegawcze leczenie donosowe lub cewnikowe jest skuteczne w zmniejszaniu ryzyka zakażenia miejsca cewnika u osób leczonych przewlekłą dializą otrzewnową.
Opór
Wkrótce po rozpoczęciu klinicznego stosowania mupirocyny pojawiły się szczepy Staphylococcus aureus, które były oporne na mupirocynę, ze skutecznością usuwania nozdrzy poniżej 30%. Wyizolowano dwie odrębne populacje S. aureus opornego na mupirocynę . Jeden szczep wykazywał niski poziom odporności, MuL ( MIC = 8–256 mg/L), a inny wysoki poziom odporności, MuH (MIC > 256 mg/L). Oporność szczepów MuL jest prawdopodobnie spowodowana mutacjami w syntetazie izoleucylo-tRNA typu dzikiego organizmu . W E. coli IleRS wykazano, że pojedyncza mutacja aminokwasowa zmienia oporność na mupirocynę. MuH jest powiązany z nabyciem oddzielnego genu syntetazy Ile, MupA. Mupirocyna nie jest skutecznym antybiotykiem przeciwko szczepom MuH. Wykazano, że inne antybiotyki, takie jak kwas azelainowy , nitrofurazon , sulfadiazyna srebra i ramoplanina, są skuteczne przeciwko szczepom MuH.
Większość szczepów Cutibacterium acnes , czynnika wywołującego trądzik pospolity , jest naturalnie oporna na mupirocynę.
Mechanizm działania mupirocyny różni się od innych antybiotyków klinicznych, co sprawia, że oporność krzyżowa na inne antybiotyki jest mało prawdopodobna. Jednakże, gen MupA może współ-transferu z innymi antybakteryjnymi genów oporności. Zaobserwowano to już w przypadku genów oporności na triklosan , tetracyklinę i trimetoprim . Może również skutkować przerostem niewrażliwych organizmów.
Mechanizm akcji
Kwas pseudomonowy hamuje syntetazę izoleucyny tRNA w bakteriach, prowadząc do wyczerpania izoleucylo-tRNA i akumulacji odpowiedniego nienaładowanego tRNA. Ubytek izoleucylo- tRNA powoduje zahamowanie syntezy białek . Nienaładowana forma tRNA wiąże się z miejscem wiązania aminoacylo-tRNA rybosomów, wywołując tworzenie (p)ppGpp , co z kolei hamuje syntezę RNA. Połączone hamowanie syntezy białek i syntezy RNA powoduje bakteriostazę. Ten mechanizm działania jest wspólny z furanomycyną , analogiem izoleucyny.
Biosynteza


Mupirocyna jest mieszaniną kilku kwasów pseudomonowych, przy czym kwas pseudomonowy A (PA-A) stanowi ponad 90% mieszaniny. W mupirocynie obecny jest również kwas pseudomonowy B z dodatkową grupą hydroksylową przy C8, kwas pseudomonowy C z podwójnym wiązaniem między C10 i C11 zamiast epoksydu PA-A oraz kwas pseudomonowy D z podwójnym wiązaniem przy C4` i C5 ` w części mupirocyny zawierającej kwas 9-hydroksynonanowy.
Biosynteza kwasu pseudomonowego A
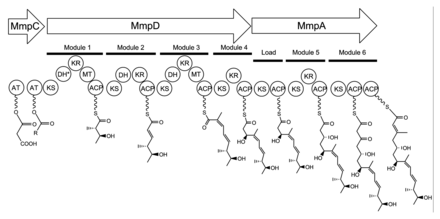
Klaster genów mupirocyny o długości 74 kb zawiera sześć wielodomenowych enzymów i dwadzieścia sześć innych peptydów (Tabela 1). Kodowane są cztery duże wielodomenowe białka syntazy poliketydowej typu I (PKS), a także kilka jednofunkcyjnych enzymów o podobieństwie sekwencji do PKS typu II. Dlatego uważa się, że mupirocyna jest konstruowana przez mieszany układ PKS typu I i typu II. Klaster mupirocyn wykazuje nietypową organizację acylotransferazy (AT), ponieważ istnieją tylko dwie domeny AT i obie znajdują się na tym samym białku, MmpC. Te domeny AT są jedynymi domenami obecnymi w MmpC, podczas gdy pozostałe trzy białka PKS typu I nie zawierają domen AT. Szlak mupirocynowy zawiera również kilka dubletów lub trojaczków tandemowych acylowych białek nośnikowych . Może to być przystosowanie do zwiększenia przepustowości lub jednoczesnego wiązania wielu substratów.
Kwas Pseudomonowy A jest produktem estryfikacji między 17C kwasem poliketydowym a 9C kwasem tłuszczowym 9-hydroksynonanowym. Możliwość, że cała cząsteczka jest złożona jako pojedynczy poliketyd z utlenianiem Baeyera-Villigera wprowadzającym tlen do szkieletu węglowego została wykluczona, ponieważ C1 kwasu monowego i C9' kwasu 9-hydroksynonanowego pochodzą od C1 octan.
| Gen | Funkcjonować |
|---|---|
| mupA | FMN H 2 zależne oksygenazy |
| mmpA | KS AKP KS KR AKP KS AKP AKP |
| mupB | Syntaza 3-oksoacylo-ACP |
| mmpB | KS DH KR ACP ACP ACP TE |
| mmpC | W AT |
| mmpD | KS DH KR MeT ACP KS DH KR ACP KS DH KR MeT ACP KS KR ACP |
| mupC | NADH / NADPH oksydoreduktaza |
| macpA | AKP |
| mupD | reduktaza 3-oksoacylo-ACP |
| mupE | reduktaza enoilowa |
| macpB | AKP |
| mupF | KR |
| macpC | AKP |
| mupG | Syntaza 3-oksoacylo-ACP I |
| mupH | Syntaza HMG-CoA |
| mupJ | hydrataza enoilo-CoA |
| mupK | hydrataza enoilo-CoA |
| mmpE | hydrolaza KS |
| mupL | domniemana hydrolaza |
| mupM | syntaza izoleucyl-tRNA |
| mupN | transferaza fosfopantetheinylowa |
| mupO | cytochrom P450 |
| mupP | nieznany |
| mupQ | syntaza acylo-CoA |
| mupS | reduktaza 3-oksoacylo-ACP |
| macpD | AKP |
| mmpF | KS |
| macpE | AKP |
| mupT | dioksygenaza ferredoksyny |
| mupU | syntaza acylo-CoA |
| mupV | oksydoreduktaza |
| mupW | dioksygenaza |
| mupR | Aktywator transkrypcyjny reagujący na N-AHL |
| mupX | amidaza /hydrolaza |
| mupI | Syntaza N-AHL |
Biosynteza kwasu monowego
Biosynteza jednostki kwasu monowego 17C rozpoczyna się na MmpD (Rysunek 1). Jedna z domen AT z MmpC może przenosić aktywowaną grupę acetylową z acetylo-koenzymu A (CoA) do pierwszej domeny ACP. Łańcuch jest wydłużany przez malonylo-CoA, po którym następuje zależna od SAM metylacja przy C12 (patrz Figura 2 dla numeracji PA-A) i redukcja grupy B-keto do alkoholu. Przewiduje się, że domena odwodnienia (DH) w module 1 jest niefunkcjonalna z powodu mutacji w konserwowanym regionie miejsca aktywnego . Moduł 2 dodaje kolejne dwa węgle przez jednostkę przedłużającą malonylo-CoA, po czym następuje ketoredukcja (KR) i odwodnienie. Moduł trzeci dodaje jednostkę przedłużającą malonylo-CoA, po której następuje zależna od SAM metylacja na C8, ketoredukcja i odwodnienie. Moduł 4 rozszerza cząsteczkę o jednostkę malonylo-CoA, po której następuje ketoredukcja.
Montaż kwasu monowego jest kontynuowany przez przeniesienie produktu 12C MmpD do MmpA. Dwie kolejne rundy rozszerzenia o jednostki malonyl-CoA są osiągane przez moduł 5 i 6. Moduł 5 zawiera również domenę KR.
Krawiectwo po PKS
Grupę ketonową w C3 zastępuje się grupą metylową w reakcji wieloetapowej (Rysunek 3). MupG zaczyna się od dekarboksylacji malonylo-ACP. Alfa węgla uzyskanego acetylo-ACP jest związana C3 łańcucha poliketydu o MupH. Ten związek pośredni jest odwadniany i dekarboksylowany odpowiednio przez MupJ i MupK.
Tworzenie pierścienia piranowego wymaga wielu etapów, w których pośredniczą enzymy (Figura 4). Proponuje się, aby podwójne wiązanie między C8 i C9 migrowało między C8 i C16. Eksperymenty z nokautem genów mupO, mupU, mupV i macpE wyeliminowały wytwarzanie PA-A. Produkcja PA-B nie jest usuwana przez te nokauty, co pokazuje, że PA-B nie jest tworzony przez hydroksylowanie PA-A. Nokaut mupW wyeliminował pierścień piranu, identyfikując MupW jako zaangażowany w tworzenie pierścienia. Nie wiadomo, czy zachodzi to przed czy po estryfikacji kwasu monowego do kwasu 9-hydroksynonanowego.
Uważa się, że epoksyd PA-A w C10-11 jest wstawiany po utworzeniu piranu przez cytochrom P450, taki jak MupO. Nokaut genu mupO zniósł produkcję PA-A, ale PA-B, który zawiera również epoksyd C10-C11, pozostał. Wskazuje to, że MupO albo nie jest zaangażowany, albo nie jest niezbędny w tym etapie epoksydowania.
Biosynteza kwasu 9-hydroksy-nonanowego
Dziewięciowęglowy kwas tłuszczowy, kwas 9-hydroksynonanowy (9-HN) jest pochodną oddzielnego związku, a następnie estryfikowanego do kwasu monowego z wytworzeniem kwasu pseudomonowego . 13 C oznaczone octan podawanie wykazało C1-C6, które są wykonane z octanu kanonicznej mody tłuszczowego syntezy kwasów . C7' pokazuje tylko znakowanie C1 octanu, podczas gdy C8' i C9' pokazują odwrócony wzór octanu znakowanego 13C. Przypuszcza się, że C7-C9 powstaje z wyjściowej jednostki 3-hydroksypropionianu, która jest trzykrotnie rozszerzona malonylo-CoA i całkowicie zredukowana do 9-HN. Sugerowano również, że 9-HN jest inicjowany przez kwas 3-hydroksy-3-metyloglutarowy (HMG). Teoria ta ostatnia nie jest obsługiwany przez podawanie [3- 14 C] lub [3,6- 13 C 2 ] -HMG.
Proponuje się, aby MmpB katalizował syntezę 9-HN (Rysunek 5). MmpB zawiera domenę KS, KR, DH, 3 ACP i domenę tioesterazy (TE). Nie zawiera domeny reduktazy enoilowej (ER), która byłaby wymagana do całkowitej redukcji do dziewięciowęglowego kwasu tłuszczowego. MupE jest białkiem jednodomenowym, które wykazuje podobieństwo sekwencji do znanych domen ER i może zakończyć reakcję. Pozostaje również możliwe, że kwas 9-hydroksynonanowy pochodzi częściowo lub całkowicie spoza klastra mupirocyn.
Bibliografia
Zewnętrzne linki
- „Mupirocyna” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.


