Mikotoksyna T-2 - T-2 mycotoxin

|
|

|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
3-metylobutanian (2α, 3α, 4β, 8α) -4,15-bis (acetyloksy) -3-hydroksy-12,13-epoksytrichotec-9-en-8-ylu
|
|
| Inne nazwy
Toksyna T-2
Fuzariotoksyna T 2 Insariotoksyna Mikotoksyna T 2 |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.040.255 |
|
PubChem CID
|
|
| Numer RTECS | |
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 24 H 34 O 9 | |
| Masa cząsteczkowa | 466,527 g · mol −1 |
| Nierozpuszczalny | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencje Infobox | |
Mikotoksyna T-2 (wymawiana jako „Tee-Two”) jest mikotoksyną trichotecenową . Jest to naturalnie występujący produkt uboczny pleśni Fusarium spp. grzyb, który jest toksyczny dla ludzi i zwierząt. Stan kliniczny, jaki wywołuje, to aleukia toksyczna pokarmowo i szereg objawów związanych z narządami tak różnorodnymi, jak skóra, drogi oddechowe i żołądek. Spożycie może wynikać ze spożycia spleśniałych pełnych ziaren . T-2 może być wchłaniany przez ludzką skórę. Chociaż nie oczekuje się żadnych znaczących skutków ogólnoustrojowych po kontakcie ze skórą w normalnym środowisku rolniczym lub mieszkalnym, nie można wykluczyć miejscowych skutków dla skóry. Dlatego należy ograniczyć kontakt skóry z T-2.
Historia
Toksyczna aleukia pokarmowa (ATA), choroba wywoływana przez trichoteceny, takie jak mykotoksyna T-2, zabiła wiele tysięcy obywateli ZSRR w okręgu Orenburg w latach czterdziestych XX wieku. Podano, że śmiertelność wyniosła 10% całej populacji na tym terenie. W latach 70. sugerowano, że przyczyną masowego zatrucia było spożycie skażonej żywności. Z powodu II wojny światowej zbiory zbóż były opóźnione, aw Rosji brakowało żywności. Spowodowało to spożycie ziarna zanieczyszczonego pleśniami Fusarium , które wytwarzają mykotoksynę T-2.
Chociaż jest to nadal kontrowersyjne, podejrzewa się, że mykotoksyna T-2 była stosowana jako chemiczny środek bojowy od lat 70. do 90. Opierając się na opisach naocznych świadków i ofiar, mikotoksyna T-2 była głównie dostarczana przez nisko latające samoloty, które uwalniały żółtą oleistą ciecz. Stąd też zjawisko to nazywane jest „ żółtym deszczem ”.
W 1982 r. Sekretarz stanu USA Alexander Haig i jego następca George P. Shultz oskarżyli Związek Radziecki o używanie mikotoksyny T-2 jako broni chemicznej w Laosie (1975–81), Kampuczi (1979–81) i Afganistanie (1979) –81), gdzie rzekomo spowodowało tysiące ofiar. Chociaż kilku amerykańskich ekspertów ds. Broni chemicznej zidentyfikowało próbki „żółtego deszczu” z Laosu jako trichoteceny, inni eksperci uważają, że narażenie to było spowodowane naturalnie występującą mykotoksyną T-2 w skażonej żywności. Drugą alternatywną teorię opracował biolog z Harvardu Matthew Meselson , który zaproponował, że „żółty deszcz” występujący w Azji Południowo-Wschodniej pochodzi z odchodów pszczół z dżungli. Pierwszą wskazówką dla tej teorii było stwierdzenie wysokiego poziomu pyłków w pobranych próbkach, nadających substancji jej żółty kolor. Stwierdzono również, że pszczoły dżungli na tym obszarze latają zbiorowo w dużych ilościach, na wysokościach zbyt dużych, by można je było łatwo zobaczyć, wytwarzając deszcze odchodów, które można było pomylić z rozpryskami z samolotów.
Uważa się również, że mykotoksyna T-2 jest przyczyną zespołu wojny w Zatoce Perskiej . Wojska amerykańskie cierpiały na objawy podobne do mykotoksykozy po zdetonowaniu irackiego pocisku w obozie wojskowym USA w Arabii Saudyjskiej podczas operacji Pustynna burza w wojnie w Zatoce Perskiej w 1991 roku. Wykazano, że Irak badał między innymi mikotoksyny trichotcenowe, a tym samym był zdolny do posiadania i wykorzystania go w wojnie chemicznej . Niemniej jednak wiele kluczowych informacji z tych incydentów pozostaje utajnionych, pozostawiając te kwestie nadal nierozwiązane.
Właściwości chemiczne
Ten związek ma układ pierścieni tetracyklicznych seskwiterpenoidów 12,13-epoksytrichotenowych, który wiąże go z trichotecenami. Związki te są na ogół bardzo stabilne i nie ulegają degradacji podczas przechowywania / mielenia i gotowania / przetwarzania żywności. Nie degradują się również w wysokich temperaturach. Ten związek ma pierścień epoksydowy i kilka grup acetylowych i hydroksylowych na łańcuchach bocznych. Te cechy są głównie odpowiedzialne za aktywność biologiczną związku i powodują, że jest on wysoce toksyczny. Mikotoksyna T-2 jest zdolna do hamowania syntezy DNA i RNA in vivo i in vitro oraz może wywoływać apoptozę . Jednak in vivo związek szybko metabolizuje do mikotoksyny HT-2 (główny metabolit ).
Mechanizm akcji
Toksyczność z toksyna T-2, zgodnie z jego pierścieniem 12,13-epoksy. Epoksydy są na ogół związkami toksycznymi; te reagują z nukleofilami, a następnie przechodzą dalsze reakcje enzymatyczne . Reaktywność epoksydów może prowadzić do reakcji ze związkami endogennych i składników komórkowych, takich jak bazy i białek DNA. Te reakcje mogą być przyczyną zauważonego działania i skutków mykotoksyny T-2. Toksyczny związek wpływa na metabolizm z membran fosfolipidów , prowadzi do wzrostu wątroby lipidów peroksydazy i ma działanie hamujące syntezę DNA i RNA. Ponadto może wiązać się z peptydylotransferazą , integralną częścią podjednostki rybosomalnej lat 60. , hamując w ten sposób syntezę białek . Uważa się, że te efekty są wyjaśnieniem wywoływania apoptozy (śmierci komórek) przez toksynę T-2 w różnych tkankach, takich jak układ odpornościowy , tkanka przewodu pokarmowego, a także tkanka płodu. W odniesieniu do apoptozy odnotowano wzrost poziomu czynnika proapoptotycznego Bas (białko X związane z Bcl-2) oraz obniżenie poziomu Bcl-xl, czynnika antyapoptotycznego w ludzkich chrondocytach ( chrząstka komórki). Po wystawieniu na działanie mykotoksyny T-2. Ponadto zwiększył się poziom Fas, antygenu powierzchniowego komórki związanego z apoptozą i białka p53, regulującego cykl komórkowy.
Synteza
T-2 mikotoksyną jest wytwarzany w sposób naturalny przez Fusarium grzybów, których większość ważnych gatunków są: F. sporotrichioides , F. langsethiae , F. kończyste i F. poae . Grzyby te znajdują się w zbożach, takich jak jęczmień , pszenica i owies . Wytwarzanie tego związku do celów badawczych i komercyjnych odbywa się na ogół przez hodowanie na płytkach agarowych pewnego szczepu grzybów wytwarzających mikotoksynę T-2 . Na tych płytkach agarowych grzyby wyglądają na sproszkowane i mogą dostarczać znaczne ilości mykotoksyny T-2. Do izolacji związku powszechnie stosuje się wysokociśnieniową chromatografię cieczową (HPLC).
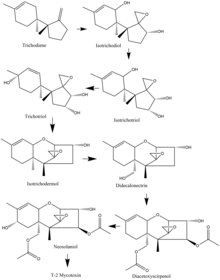
U gatunków Fusarium biosynteza mykotoksyny T-2 często rozpoczyna się od trichodienu, a wiele gatunków ma wspólną drogę utleniania i cyklizacji . Na przykład, w przypadku gatunków F. sporotrichioides , ważne etapy utleniania, które zachodzą, rozpoczynają się od trichodienu i przechodzą do izotrichodiolu. Stamtąd jedenasty atom węgla jest utleniany do izotrichotriolu. Dziewiąty węgiel jest następnie utleniany i powstaje trichotriol, który następnie cyklizuje, tworząc izotrichodermol. Następnie piętnasty węgiel jest utleniany, tworząc didekalonektrynę, co prowadzi do utleniania czwartego węgla i powstaje diacetoksyscyrpenol. Przedostatnim etapem jest utlenianie ósmego węgla w celu wytworzenia neosolaniolu, który następnie podlega niewielkiej modyfikacji w celu wytworzenia toksyny T-2.
Toksyczność
Właściwości ADME
Absorpcja i ekspozycja
Ludzie i zwierzęta są na ogół narażeni na mikotoksyny T-2 poprzez żywność. Niektóre zboża mogą zawierać toksynę, co stanowi zagrożenie dla zdrowia ludzkiego i obciążenie ekonomiczne. W przeciwieństwie do większości toksyn biologicznych mykotoksyna T-2 może być wchłaniana przez nienaruszoną skórę. Związek może być dostarczany z pożywieniem, wodą, kroplami, aerozolami i dymem z różnych systemów dyspersji. To sprawia, że jest to potencjalna broń biologiczna , jednak duże ilości związku są wymagane do śmiertelnej dawki . T-2 mykotoksyn ma LD 50 około 1 mg na kilogram masy ciała.
EFSA ocenia, że średnia ekspozycja T-2 w UE leży między 12 i 43 ng / kg mc / dzień. Zakres ten jest niższy od TDI wynoszącego 100 ng / kg masy ciała dla sumy toksyn HT-2 i T-2, które są stosowane przez EFSA.
Dystrybucja
Mikotoksyna T-2 jest równomiernie rozprowadzana po całym organizmie, bez preferencji w określonym narządzie lub miejscu. U gryzoni maksymalne stężenie w osoczu trwa około trzydzieści minut po ekspozycji, aw jednym badaniu okres półtrwania toksyny T-2 okazał się krótszy niż dwadzieścia minut. W innym badaniu obejmującym świnie zaobserwowano, że dystrybucja po czterech godzinach od wstrzyknięcia dożylnego wynosiła 15–24% w przewodzie pokarmowym i 4,7–5,2% w różnych innych tkankach.
Metabolizm
Po wchłonięciu i dystrybucji do różnych tkanek mikotoksyna T-2 przechodzi różne reakcje metaboliczne, zanim zostanie wydalona. Badania in vivo wykazały, że najczęściej występującymi reakcjami są hydroliza estrów i hydroksylacja grupy izowalerylowej. Występują również głębokie utlenianie i sprzęganie z glukuronidem . Głównym metabolitem jest Ht-2. Sugeruje się, że w hydroksylacji bierze udział kompleks enzymatyczny cytochromu p450. Triol T-2 i tetraol T-2 są najprawdopodobniej tworzone przez esterazy acetylocholinowe . Niektóre reakcje metaboliczne mykotoksyny są wykonywane przez mikroflorę jelitową. Metabolity powstające w tych reakcjach są zależne od gatunku i pH. Jednak rozszczepianie estrów jest wykonywane przez samego ssaka, a nie przez mikroflorę. W krwinkach czerwonych mikotoksyna T-2 jest metabolizowana do neosolaniolu, aw białych krwinkach do HT-2 poprzez hydrolizę katalizowaną przez karboksyloesterazy.
Wydalanie
Po wchłonięciu, dystrybucji i metabolizmie mykotoksyna T-2 jest wydalana dość szybko, z czego 80-90% jest wydalane w ciągu 48 godzin. Wydaje się, że główne metody wydalania pochodzą z moczu i kału, przy czym wydalanie z żółcią w znacznym stopniu przyczynia się do drogi wydalania kału. W wydalinach jest również bardzo mało macierzystej mikotoksyny T-2, co oznacza, że większość początkowego związku jest wcześniej metabolizowana.
Skutki toksyczne
T-2 jest silnie toksyczny przy wdychaniu. Ostre objawy toksyczne obejmują wymioty, biegunkę, podrażnienie skóry, swędzenie, wysypkę, pęcherze, krwawienie i duszność . Jeśli osoba jest narażona na T-2 przez dłuższy czas, rozwija się toksyczna aleukia pokarmowa (ATA).
Początkowo pacjent odczuwa pieczenie w jamie ustnej, gardle i żołądku. Po kilku dniach osoba będzie cierpieć na ostre zapalenie żołądka i jelit, które będzie trwało od 3 do 9 dni. W ciągu 9 tygodni szpik kostny będzie powoli degenerować. Również skóra zaczyna krwawić, a całkowita liczba leukocytów spada. Mogą wystąpić problemy z układem nerwowym.
Ostatecznie mogą wystąpić następujące objawy: wysoka gorączka, krwotok wybroczynowy , martwica mięśni i skóry, infekcje bakteryjne tkanki martwiczej, powiększone węzły chłonne . Istnieje możliwość uduszenia z powodu krtani obrzęk i zwężenie części głośni . Brak tlenu jest wówczas przyczyną śmierci. W przeciwnym razie pacjent umrze z powodu oskrzelowego zapalenia płuc i krwawienia z płuc.
Wpływ na zwierzęta
Mikotoksyna T-2 jest również toksyczna dla zwierząt. Związek ten znany jest z zabójczego i subletalnego wpływu na zwierzęta gospodarskie. Często występuje w zanieczyszczonych ziarnach zbóż, którymi karmione są te zwierzęta. Większość toksycznych skutków dotyczy ludzi i zwierząt. Po wystawieniu zarodków danio pręgowanego na działanie stężenia 20 μmol / l lub wyższego zniekształcenia i śmiertelność wzrosły. Wady rozwojowe obejmowały deformacje ogona, wady sercowo-naczyniowe i zmiany w zachowaniu we wczesnych stadiach życia. Jest to wynikiem wzrostu ilości epoksydów, które powodują apoptozę komórek. Inne badania wykazały, że toksyna T-2 powoduje peroksydację lipidów u szczurów po jej podaniu. W wyniku działania toksyny T-2 u kilku gatunków ssaków zaobserwowano podwyższone poziomy reaktywnych form tlenu (RFT). Jednak pomimo ogólnych szkodliwych skutków powodowanych przez toksynę, w badaniu przeprowadzonym na różnych modelach hodowli komórek wątroby pochodzących od kurczaków nie stwierdzono żadnych zmian w stanie redoks komórek.
Wydaje się również, że związek zmniejsza płodność maciorek i jałówek. Badania wykazały, że wysoka dawka T-2 opóźnia owulację z powodu opóźnionego dojrzewania pęcherzyków . To prawdopodobnie opóźnia następującą luteinizację , która uniemożliwia poczęcie samicom.
T-2 ma również wpływ na płodność byków. W 1998 roku stwierdzono, że spleśniałe siano wpłynęło na jakość nasienia buhajów. Analiza spleśniałego siana wykazała obecność T-2. Związek zmniejszał ruchliwość plemników i poziom testosteronu oraz zwiększał częstotliwość nieprawidłowości morfologicznych w plemnikach.
Wątroba jest kolejnym celem mykotoksyny. Jest to jeden z pierwszych narządów, przez które przechodzi związek po spożyciu. Tutaj powoduje zmniejszoną ekspresję białek CYP1A u królików, świń i szczurów. Aktywność CYP3A spada również u świń. Enzymy te pomagają metabolizować leki przechodzące przez wątrobę. Zmniejszenie aktywności może prowadzić do zwiększenia ilości niezmetabolizowanych leków w osoczu. Może to mieć niebezpieczny wpływ na zdrowie zwierząt.
Wszystkie wymienione efekty występują, gdy T-2 jest przyjmowany w dużych dawkach. Zwierzęta są w stanie metabolizować związek za pomocą enzymów z rodziny CYP3A, podobnie jak ludzie.
Zabiegi
W tej chwili nie ma specyficznej terapii zatruć mikotoksynami T-2. Po ekspozycji na mikotoksynę zwykle następuje standardowe leczenie związków toksycznych w celu zmniejszenia działania toksyny. Obejmuje to użycie węgla aktywnego , który ma wysoką zdolność wiązania 0,48 mg mykotoksyny T-2 do 1 mg węgla drzewnego. W przypadku kontaktu ze skórą stosuje się mydło i wodę w celu zmniejszenia skutków skórnych. Jako rodzaj profilaktyki , przeciwutleniacze Uważa się, że mają właściwości, które mogą przynieść korzyści.
Podanie
Obecnie nie ma zastosowań, poza wojną, dla mykotoksyn T-2; jednak istnieją pewne prawdopodobne zastosowania terapeutyczne. Ze względu na ich możliwości badania wskazują na możliwe zastosowania mykotoksyny jako promotorów wzrostu, antybiotyków , leków przeciwwirusowych , przeciwbiałaczkowych i przeciwmalarycznych .
Zobacz też
Bibliografia
- Bamburg, JR, Riggs, NV i Strong, FM „Struktura toksyn z dwóch plam Fusarium tricinctum”. Tetrahedron 24, 3329-3336 (1968).
- Bamburg, JR and Strong, FM „12, 13-Epoxytrichothecenes”. W „Microbial Toxins”, VII S. Kadis, A. Ciegler i SJ Ajl (red.) Academic Press, Nowy Jork, NY, str. 207–292 (1971).
Książki
- Podręcznik postępowania medycznego USAMRIID z ofiarami biologicznymi