Termogenina - Thermogenin
Termogenina (zwana przez odkrywców białkiem rozprzęgającym, a obecnie znana jako białko rozprzęgające 1 lub UCP1 ) jest mitochondrialnym białkiem nośnikowym występującym w brązowej tkance tłuszczowej (BAT). Wykorzystywany jest do wytwarzania ciepła poprzez termogenezę bez dreszczy i w istotny sposób przyczynia się do przeciwdziałania utracie ciepła u niemowląt, która w innym przypadku miałaby miejsce ze względu na wysoki stosunek powierzchni do objętości.
Mechanizm
UCP to białka transbłonowe, które zmniejszają gradient protonów generowany podczas fosforylacji oksydacyjnej. Robią to poprzez zwiększenie przepuszczalności wewnętrznej błony mitochondrialnej, umożliwiając protonom wpompowanym do przestrzeni międzybłonowej powrót do macierzy mitochondrialnej. Wytwarzanie ciepła za pośrednictwem UCP1 w brązowym tłuszczu odłącza łańcuch oddechowy, umożliwiając szybkie utlenianie substratu przy niskim tempie produkcji ATP. UCP1 jest powiązany z innymi mitochondrialnymi transporterami metabolitów, takimi jak translokator nukleotydów adeninowych, kanał protonowy w błonie wewnętrznej mitochondriów, który umożliwia translokację protonów z przestrzeni międzybłonowej mitochondriów do macierzy mitochondrialnej . UCP1 ogranicza się do brązowej tkanki tłuszczowej , gdzie zapewnia mechanizm ogromnej zdolności tkanki do wytwarzania ciepła.
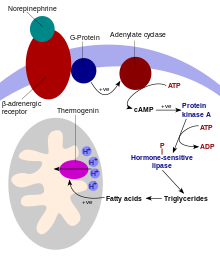
UCP1 jest aktywowany w brunatnej komórce tłuszczowej przez kwasy tłuszczowe i hamowany przez nukleotydy. Kwasy tłuszczowe są uwalniane przez następującą kaskadę sygnalizacyjną: Zaciski współczulnego układu nerwowego uwalniają noradrenalinę na receptor adrenergiczny beta-3 na błonie komórkowej . To aktywuje cyklazę adenylylową , która katalizuje konwersję ATP do cyklicznego AMP (cAMP). cAMP aktywuje kinazę białkową A , powodując uwolnienie jej aktywnych podjednostek C od regulatorowych podjednostek R. Aktywna kinaza białkowa A z kolei fosforyluje lipazę triacyloglicerolową , tym samym ją aktywując. Konwertuje lipazy triacylogliceroli do wolnych kwasów tłuszczowych, które aktywują UCP1, zastępując hamowania spowodowane nukleotydów purynowych ( PKB i ADP ). Podczas zakończenia termogenezy, termogenina jest inaktywowana, a pozostałe kwasy tłuszczowe są usuwane poprzez utlenianie, umożliwiając komórce powrót do normalnego stanu oszczędzania energii.
UCP1 jest bardzo podobny do białka nośnikowego ATP/ADP lub translokatora nukleotydów adeninowych ( ANT ). Proponowany model dostępu naprzemiennego dla UCP1 opiera się na podobnym mechanizmie ANT. Podłoże wchodzi do półotwartej białka UCP1 z cytoplazmy stronie membrany, białko zamyka cytoplazmatyczną bok tak, podłoże jest zamknięte w białko, a następnie po stronie matrycy białka otwiera się, dzięki czemu podłoże będzie udostępniony macierzy mitochondrialnej . Otwieranie i zamykanie białka odbywa się poprzez zaciskanie i rozluźnianie mostków solnych na powierzchni błony białka. Uzasadnienie tego modelowania UCP1 na ANT znajduje się w wielu konserwowanych resztach między dwoma białkami, które są aktywnie zaangażowane w transport substratu przez błonę. Oba białka są integralnymi białkami błonowymi , zlokalizowanymi w wewnętrznej błonie mitochondrialnej i mają podobny wzór mostków solnych, reszt proliny i hydrofobowych lub aromatycznych aminokwasów, które mogą się zamykać lub otwierać w stanie cytoplazmatycznym lub macierzy.
Ewolucja
UCP1 ulega ekspresji w brunatnej tkance tłuszczowej, która funkcjonalnie występuje tylko u owadów . Gen UCP1, czyli termogenina, prawdopodobnie powstał u przodka współczesnych kręgowców , ale początkowo nie pozwalał naszemu przodkowi kręgowców na wykorzystanie termogenezy bez dreszczy do ogrzewania . Dopiero generacji ciepła adaptacyjnie wybiera się w łożyska potomków ssaków tego wspólnego przodka UCP1 rozwinęła obecną funkcję brunatnej tkanki tłuszczowej w celu zapewnienia dodatkowego ciepła. Podczas gdy UCP1 odgrywa kluczową rolę termogeniczną u wielu ssaków łożyskowych, szczególnie tych o małych rozmiarach ciała i tych, które hibernują, gen UCP1 utracił funkcjonalność w kilku liniach o dużych ciałach (np. konie , słonie , krowy morskie , wieloryby i góralki ) i linie o niskim tempie przemian metabolicznych (np. łuskowce , pancerniki , leniwce i mrówkojady ). Ostatnie odkrycia niegenerujących ciepła ortologów UCP1 u ryb i torbaczy , innych potomków przodków współczesnych kręgowców, pokazują, że ten gen został przekazany wszystkim współczesnym kręgowcom, ale poza ssakami łożyskowymi żaden nie ma zdolności wytwarzania ciepła. Sugeruje to dalej, że UCP1 miał inny pierwotny cel i faktycznie analizy filogenetyczne i sekwencyjne wskazują, że UCP1 jest prawdopodobnie zmutowaną formą dikarboksylanowego białka nośnikowego, które przystosowało się do termogenezy u ssaków łożyskowych.
Historia
Naukowcy z lat 60. badający brązową tkankę tłuszczową odkryli, że oprócz wytwarzania większej ilości ciepła niż typowe dla innych tkanek, brązowa tkanka tłuszczowa wydawała się zwierać lub rozprzęgać sprzężenie oddechowe. Białko rozprzęgające 1 zostało odkryte w 1978 roku przez Davida Nichollsa, Vibeke Bernson i Gillian Heaton i okazało się, że jest białkiem odpowiedzialnym za ten efekt rozprzęgania. UCP1 został później po raz pierwszy oczyszczony w 1980 roku i po raz pierwszy sklonowany w 1988 roku.
Rozprzęgające białko dwa (UCP2), homolog UCP1, zostało zidentyfikowane w 1997 roku. UCP2 lokalizuje się w wielu różnych tkankach i uważa się, że bierze udział w regulacji reaktywnych form tlenu (ROS). W ostatniej dekadzie zidentyfikowano trzy dodatkowe homologi UCP1, w tym UCP3 , UCP4 i UCP5 (znane również jako BMCP1 lub SLC25A14).
Znaczenie kliniczne
Metody dostarczania UCP1 do komórek poprzez terapię transferu genów lub metody jego regulacji w górę są ważnym kierunkiem badań nad leczeniem otyłości, ze względu na ich zdolność do rozpraszania nadmiaru zapasów metabolicznych.
Zobacz też
- 2,4-Dinitrofenol (syntetyczny drobnocząsteczkowy transporter protonowy o podobnych efektach)
Bibliografia
Dalsza lektura
- Macher, Gabriel; Koehlera, Melanie; Rupprecht, Anna; Kreiter, Jürgen; Hinterdorfer, Piotr; Pohl, Elena E. (marzec 2018). „Hamowanie mitochondrialnego UCP1 i UCP3 przez nukleotydy purynowe i fosforany” . Biochimica et Biophysica Acta (BBA) - Biomembrany . 1860 (3): 664–672. doi : 10.1016/j.bbamem.2017.12.001 . PMC 6118327 . PMID 29212043 .
- Urbánkova, Eva; Voltchenko, Anna; Pohl, Piotr; Ježek, Petr; Pohl, Elena E. (29 sierpnia 2003). „Kinetyka transportu białek rozprzęgających” . Czasopismo Chemii Biologicznej . 278 (35): 32497–32500. doi : 10.1074/jbc.M303721200 . PMID 12826670 .
- Ricquier D, Bouillaud F (styczeń 2000). „Rozprzęgające homologi białkowe: UCP1, UCP2, UCP3, StUCP i AtUCP” . Czasopismo Biochemiczne . 345 Pt 2 (2): 161–79. doi : 10.1042/0264-6021:3450161 . PMC 1220743 . PMID 10620491 .
- Muzzin P (kwiecień 2002). „Białka rozprzęgające”. Annales d'Endocrinologie . 63 (2 pkt 1): 106–10. PMID 11994670 .
- Del Mar Gonzalez-Barroso M, Ricquier D, Cassard-Doulcier AM (październik 2000). „Ludzki gen białka rozprzęgającego-1 (UCP1): stan obecny i perspektywy w badaniach nad otyłością”. Recenzje otyłości . 1 (2): 61–72. doi : 10.1046/j.1467-789x.2000.00009.x . PMID 12119988 . S2CID 30231289 .
- Cassard AM, Bouillaud F, Mattei MG, Hentz E, Raimbault S, Thomas M, Ricquier D (lipiec 1990). „Ludzki gen białka rozprzęgającego: struktura, porównanie z genem szczura i przypisanie do długiego ramienia chromosomu 4”. Journal of Cellular Biochemistry . 43 (3): 255–64. doi : 10.1002/jcb.240430306 . PMID 2380264 . S2CID 31128860 .
- Bouillaud F, Villarroya F, Hentz E, Raimbault S, Cassard AM, Ricquier D (lipiec 1988). „Wykrywanie mRNA białka rozprzęgającego brązową tkankę tłuszczową u dorosłych pacjentów przez ludzką sondę genomową”. Nauka kliniczna . 75 (1): 21–7. doi : 10.1042/cs0750021 . PMID 3165741 .
- Oppert JM, Vohl MC, Chagnon M, Dionne FT, Cassard-Doulcier AM, Ricquier D, Pérusse L, Bouchard C (sierpień 1994). „Polimorfizm DNA w genie białka rozprzęgającego (UCP) i tkanki tłuszczowej człowieka”. International Journal of Obesity and Related Metabolic Disorders . 18 (8): 526–31. PMID 7951471 .
- Clément K, Ruiz J, Cassard-Doulcier AM, Bouillaud F, Ricquier D, Basdevant A, Guy-Grand B, Froguel P (grudzień 1996). „Dodatkowy wpływ wariantu A-->G (-3826) genu białka rozprzęgającego i mutacji Trp64Arg genu receptora beta 3-adrenergicznego na przyrost masy ciała w chorobliwej otyłości”. International Journal of Obesity and Related Metabolic Disorders . 20 (12): 1062–6. PMID 8968850 .
- Schleiff E, Shore GC, Goping IS (marzec 1997). „Ludzki mitochondrialny receptor importowy, Tom20p. Zastosowanie glutationu w celu ujawnienia specyficznych interakcji między S-transferazą Tom20-glutationu a białkami prekursorowymi mitochondriów”. Listy FEBS . 404 (2-3): 314-8. doi : 10.1016/S0014-5793(97)00145-2 . PMID 9119086 . S2CID 29177508 .
- Urhammer SA, Fridberg M, Sørensen TI, Echwald SM, Andersen T, Tybjaerg-Hansen A, Clausen JO, Pedersen O (grudzień 1997). „Badania zmienności genetycznej genu białka rozprzęgającego 1 u osób rasy kaukaskiej z otyłością młodzieńczą”. Czasopismo Endokrynologii Klinicznej i Metabolizmu . 82 (12): 4069–74. doi : 10.1210/jc.82.12.4069 . PMID 9398715 .
- Jezek P, Urbánková E (styczeń 2000). „Specyficzna sekwencja motywów mitochondrialnych białek rozprzęgających” . Życie IUBMB . 49 (1): 63–70. doi : 10.1080/713803586 . PMID 10772343 . S2CID 8541209 .
- Mori H, Okazawa H, Iwamoto K, Maeda E, Hashiramoto M, Kasuga M (marzec 2001). „Polimorfizm w nieulegającym translacji regionie 5' i wariant Met229-->Leu w eksonie 5 ludzkiego genu UCP1 są związane z podatnością na cukrzycę typu II” . Diabetologia . 44 (3): 373–6. doi : 10.1007/s001250051629 . PMID 11317671 .
- Nibbelink M, Moulin K, Arnaud E, Duval C, Pénicaud L, Casteilla L (grudzień 2001). „Brązowy tłuszcz UCP1 jest specyficznie wyrażany w podłużnych komórkach mięśni gładkich macicy” . Czasopismo Chemii Biologicznej . 276 (50): 47291-5. doi : 10.1074/jbc.M105658200 . PMID 11572862 .
- Echtay KS, Roussel D, St-Pierre J, Jekabsons MB, Cadenas S, Stuart JA, Harper JA, Roebuck SJ, Morrison A, Pickering S, Clapham JC, Brand MD (styczeń 2002). „Nadtlenek aktywuje mitochondrialne białka rozprzęgające”. Natura . 415 (6867): 96-9. Kod bib : 2002Natur.415...96E . doi : 10.1038/415096a . PMID 11780125 . S2CID 4349744 .
- Rousset S, del Mar Gonzalez-Barroso M, Gelly C, Pecqueur C, Bouillaud F, Ricquier D, Cassard-Doulcier AM (maj 2002). „Nowe miejsce polimorficzne zlokalizowane w ludzkim genie UCP1 kontroluje wiązanie in vitro czynnika podobnego do CREB” . International Journal of Obesity and Related Metabolic Disorders . 26 (5): 735-8. doi : 10.1038/sj.ijo.0801973 . PMID 12032762 .
- Obręcz JS, Kozak LP (wrzesień 2002). „Motywy regulacyjne dla białka wiążącego CREB i czynników transkrypcyjnych Nfe2l2 w górę wzmacniacza mitochondrialnego genu białka rozprzęgającego 1” . Czasopismo Chemii Biologicznej . 277 (37): 34589–600. doi : 10.1074/jbc.M108866200 . PMID 12084707 .
- Kieć-Wilk B, Wybrańska I, Malczewska-Malec M, Leszczyńska-Gołabek L, Partyka L, Niedbał S, Jabrocka A, Dembińska-Kieć A (wrzesień 2002). "Korelacja polimorfizmu -3826A >G w promotorze genu rozprzęgającego białka 1 z otyłością i zaburzeniami metabolicznymi w rodzinach otyłych z południowej Polski". Czasopismo Fizjologii i Farmakologii . 53 (3): 477–90. PMID 12375583 .
Zewnętrzne linki
- Nadzieja na tabletki przeciw otyłości z wodorostów (BBC - Termogenina wymieniona jako część procesu)
- termogenina w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)