Triamteren - Triamterene
 | |
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Dyrenium, inne |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a682337 |
Kategoria ciąży |
|
| Drogi administracji |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | 30-70% |
| Wiązanie białek | 67% |
| Metabolizm | hydroksylacja do para-hydroksytriamterenu |
| Okres półtrwania eliminacji | 1-2 godziny, aktywny metabolit 3 godziny |
| Wydalanie | nerki <50%, 21% bez zmian |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.006.278 |
| Dane chemiczne i fizyczne | |
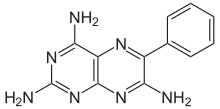
| Formuła | C 12 H 11 N 7 |
| Masa cząsteczkowa | 253,269 g·mol -1 |
| |
|
| |
Triamteren ( między innymi nazwa handlowa Dyrenium ) jest lekiem moczopędnym oszczędzającym potas, często stosowanym w połączeniu z diuretykami tiazydowymi w leczeniu wysokiego ciśnienia krwi lub obrzęków . Połączenie z hydrochlorotiazydem jest znane jako hydrochlorotiazyd/ triamteren .
Skutki uboczne
Częste działania niepożądane mogą obejmować niedobór sodu , kwasu foliowego i wapnia , nudności, wymioty, biegunkę, bóle głowy, zawroty głowy, zmęczenie i suchość w ustach. Poważne działania niepożądane mogą obejmować kołatanie serca, mrowienie/drętwienie, gorączkę, dreszcze, ból gardła, wysypkę i ból pleców. Triamteren może również powodować kamienie nerkowe poprzez bezpośrednią krystalizację lub zaszczepianie kamieni szczawianu wapnia . Najlepiej unikać triamterenu u pacjentów z przewlekłą chorobą nerek ze względu na możliwość hiperkaliemii . Osoby stosujące ten lek powinny ostrożnie stosować substytut soli .
Triamteren może nadawać moczowi niebieski, fluorescencyjny kolor.
Ostrożnie w przypadku niektórych stanów chorobowych
Cukrzyca : Stosuj ostrożnie u osób ze stanem przedcukrzycowym lub cukrzycą, ponieważ może nastąpić zmiana w kontroli glukozy.
Zaburzenia czynności wątroby : Stosować ostrożnie u osób z ciężkimi zaburzeniami czynności wątroby; w marskości należy unikać zaburzeń równowagi elektrolitowej i kwasowo- zasadowej , które mogą prowadzić do encefalopatii wątrobowej .
Niewydolność nerek : skojarzona terapia triamterenem i indometacyną powodowała u niektórych osób odwracalne ostre uszkodzenie nerek .
Kamienie nerkowe : Stosować ostrożnie u osób z kamieniami nerkowymi.
Należy unikać stosowania, jeśli klirens kreatyniny jest mniejszy niż 10 ml/minutę.
Mechanizm akcji
Triamteren bezpośrednio blokuje nabłonkowy kanał sodowy (ENaC) po stronie światła kanalika zbiorczego nerki . Inne diuretyki powodują zmniejszenie stężenia sodu w tworzącym się moczu z powodu wnikania sodu do komórki przez ENaC i jednoczesnego wychodzenia potasu z głównej komórki do tworzącego się moczu. Blokowanie ENaC zapobiega temu. W ten sam sposób działa amiloryd . Blokery kanałów sodowych bezpośrednio hamują wnikanie sodu do kanałów sodowych.
Z hydrochlorotiazydem
Triamteren jest powszechnie przygotowywany w połączeniu z hydrochlorotiazydem do leczenia nadciśnienia (wysokie ciśnienie krwi) i obrzęków (zatrzymanie wody). Ta kombinacja należy do klasy leków zwanych diuretykami lub „pigułkami na wodę” i powoduje, że nerki usuwają z moczem niepotrzebną wodę i sód .
Historia
Układ pierścieni triamterenowych znajduje się w wielu naturalnie występujących związkach, takich jak kwas foliowy i ryboflawina. Obserwacja, że naturalnie występujący związek ksantopteryna ma wpływ na nerki, skłoniła naukowców z Smith Kline i French Laboratories w Filadelfii do rozpoczęcia kampanii chemii medycznej w celu odkrycia potencjalnych leków, w ramach programu odkrywania leków moczopędnych oszczędzających potas. Pierwsze badania kliniczne opublikowano w 1961 roku, a pierwsze próby połączenia go z hydrochlorotiazydem opublikowano rok później.
Smith Kline & French wprowadził go jako pojedynczy środek pod marką Dyrenium w 1964 roku. Lek złożony z hydrochlorotiazydem, Dyazide, został po raz pierwszy zatwierdzony w USA w 1965 roku, a pierwszy generyczny, wprowadzony przez Bolar Pharmaceutical Co., został zatwierdzony w 1987 roku. W 1986 r. Dyazide był najczęściej przepisywanym lekiem w Stanach Zjednoczonych i osiągnął sprzedaż 325 milionów dolarów, co czyni go drugim co do wielkości sprzedawcą SmithKline Beckman po Tagamecie .
Patenty na Diazyd wygasły w 1980 r., ale pojawiły się komplikacje wraz z wprowadzeniem leków generycznych, ponieważ formułowanie Diazydu skutkowało różnymi partiami, które uniemożliwiły producentom leków generycznych wykazanie, że ich wersje są biorównoważne.
Firma Bolar Pharmaceutical jako pierwsza wprowadziła lek generyczny, ale jej zastosowanie zostało opóźnione z powodu obaw o to, czy jego formuła zapewnia taką samą ilość każdego leku; komplikowały je oskarżenia, że Bolar oszukańczo zastąpił Diazyd własną wersją w celu przeprowadzenia badań, które zostały przedłożone FDA. Wkrótce po zatwierdzeniu leku generycznego firmy Bolar, pojawiły się dalsze obawy dotyczące wniosków firmy Bolar o bardziej ogólny obrót lekami generycznymi; między innymi te odkrycia wzbudziły powszechne zaniepokojenie wśród lekarzy i opinii publicznej, czy leki generyczne są rzeczywiście tym samym, co markowe leki. Bolar w końcu przypomniał swoją generyczną formę Diazydu i wycofał produkt w 1990 roku. W 1991 roku Departament Sprawiedliwości Stanów Zjednoczonych w imieniu FDA wniósł 20 zarzutów karnych przeciwko firmie Bolar za oszustwo, a na początku następnego roku Bolar przyznał się do winy i zgodził się zapłacić 10 milionów dolarów grzywny. Publiczne zaniepokojenie bezpieczeństwem leków generycznych zostało dodatkowo pogłębione przez dochodzenie Kongresu w sprawie przekupstwa prowadzonego przez FDA przez firmy generyczne, które stwierdziły wszechobecną korupcję; dochodzenie zostało zainicjowane przez firmę generyczną Mylan , która zatrudniła prywatnych detektywów w oparciu o przekonanie, że konkurenci uzyskują nieuczciwą przewagę w uzyskiwaniu aprobaty ich leków generycznych.
Sam Mylan opracował wersję leku skojarzonego triamteren/hydrochlorotiazyd po wygaśnięciu patentu Dyazide i zastosował inną, bardziej stabilną formułę, a także różne dawki każdego składnika aktywnego (50 mg hydrochlorotiazydu i 75 mg triamterenu, w porównaniu z 25 mg hydrochlorotiazydu firmy Dyazide i 50 mg triamterenu), więc musiał zostać zatwierdzony jako nowy lek, w przeciwieństwie do leku generycznego; ich produkt nazywał się Maxzide i został zatwierdzony w 1984 roku. Wyższa dawka dozwolona raz dziennie, co według Mylan i jej partnera marketingowego, Lederle, pomoże mu konkurować z Dyazide, który miał 210 milionów dolarów w sprzedaży w 1983 roku.
Patenty Mylana na lek zostały unieważnione w sądzie, a jego wyłączność marketingowa wygasła w 1987 roku, wywołując falę konkurencji generycznej i sporu między dwoma z nich, American Therapeutics Inc. i Vitarine Pharmaceuticals, z FDA. Vitarine, wraz z Par Pharmaceutical , były dwiema firmami, które Mylan namierzyło w dochodzeniu w sprawie korupcji i okazało się, że Par i Vitarine używały Maxzide firmy Mylan w celu uzyskania danych dotyczących biorównoważności, co doprowadziło obie firmy do wycofania swojego konkurenta generycznego dla Mylan. produkt. Generyki ostatecznie weszły na rynek.
Badania
Chociaż brak jest randomizowanych kontrolowanych badań oceniających stosowanie triamterenu w leczeniu choroby Ménière'a , typowe leczenie to 37,5 mg triamterenu z 25 mg hydrochlorotiazydu 1–2 kapsułki dziennie. Rekomendacji tej nadano ocenę C w taksonomii siły rekomendacji (SORT).
