Strefa podkomorowa - Subventricular zone
| Strefa podkomorowa | |
|---|---|
| Identyfikatory | |
| Identyfikator NeuroLex | nlx_144262 |
| Anatomiczne terminy neuroanatomii | |

Strefa okołokomorowa ( SVZ ) to obszar znajduje się na zewnętrznej ściance każdego z komory bocznej z kręgowców mózgu. Występuje zarówno w mózgu embrionów, jak i dorosłych. W życiu embrionalnym SVZ odnosi się do wtórnej strefy proliferacyjnej zawierającej neuronalne komórki progenitorowe , które dzielą się, aby wytworzyć neurony w procesie neurogenezy . Pierwotne nerwowe komórki macierzyste mózgu i rdzenia kręgowego, zwane radialnymi komórkami glejowymi , zamiast tego znajdują się w strefie komorowej (VZ) (tak zwanej, ponieważ VZ wyściela wnętrze rozwijających się komór ).
W rozwijającej się korze mózgowej , która znajduje się w mózgowiu grzbietowym , SVZ i VZ są tkankami przejściowymi, które nie występują u osoby dorosłej. Jednak SVZ brzusznego kresomózgowia utrzymuje się przez całe życie. Dorosła SVZ składa się z czterech odrębnych warstw o różnej grubości i gęstości komórek, a także składu komórkowego. Wraz z zakrętu zębatego w hipokampie , SVZ jest jednym z dwóch miejsc, gdzie neurogenezy okazało się wystąpić w mózgu dorosłych ssaków. Neurogeneza dorosłych SVZ przyjmuje postać prekursorów neuroblastów interneuronów, które migrują do opuszki węchowej przez rostralny strumień migracyjny . Wydaje się, że SVZ bierze również udział w tworzeniu astrocytów po uszkodzeniu mózgu.
Struktura
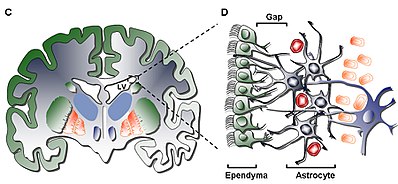
Warstwa I
Najbardziej wewnętrzna warstwa (warstwa I) zawiera pojedynczą warstwę (warstwy), w jednowarstwowej wyściółki komórek wyściełających jamę komory; komórki te posiadają rzęski wierzchołkowe i kilka podstawowych ekspansji, które mogą stać równolegle lub prostopadle do powierzchni komory. Te ekspansje mogą ściśle oddziaływać z procesami astrocytowymi , które są połączone z warstwą hipokomórkową (Warstwa II).
Warstwa II
Warstwa drugorzędowa (Warstwa II) zapewnia szczelinę hipokomórkową przylegającą do pierwszej i wykazano, że zawiera sieć funkcjonalnie skorelowanych procesów astrocytowych z dodatnim białkiem glejowym ( GFAP ), które są połączone z kompleksami złączowymi, ale nie zawierają ciał komórkowych, z wyjątkiem rzadka somata neuronalna. Chociaż funkcja tej warstwy u ludzi jest jeszcze nieznana, postawiono hipotezę, że połączenia astrocytów i wyściółki warstwy I i II mogą działać w celu regulacji funkcji neuronalnych, ustanowienia homeostazy metabolicznej i/lub kontrolowania proliferacji i różnicowania neuronalnych komórek macierzystych podczas rozwoju . Potencjalnie, takie cechy warstwy mogą działać jako pozostałość wczesnego życia rozwojowego lub szlak migracji komórek, biorąc pod uwagę podobieństwo do warstwy homologicznej w bydlęcej SVZ, która wykazuje komórki migrujące wspólne tylko dla ssaków wyższego rzędu.
Warstwa III
Trzecia warstwa (Warstwa III) tworzy wstęgę ciał komórek astrocytów , które, jak się uważa, utrzymują subpopulację astrocytów zdolnych do proliferacji in vivo i tworzenia multipotencjalnych neurosfer o zdolności do samoodnowy in vitro. Chociaż w obrębie wstążki znaleziono niektóre oligodendrocyty i komórki wyściółki , nie tylko pełnią one nieznaną funkcję, ale są rzadkie w porównaniu z populacją astrocytów, które znajdują się w warstwie. Astrocyty obecny w zewnętrznej warstwie III można podzielić na trzy populacji przez mikroskopię elektronową , bez unikalne funkcje jeszcze rozpoznawalne; pierwszy typ to mały astrocyt o długich, poziomych, stycznych wypustkach, najczęściej spotykany w warstwie II; drugi typ znajduje się między warstwami II i III oraz w obrębie wstążki astrocytów, charakteryzujący się dużymi rozmiarami i licznymi organellami; trzeci typ znajduje się zwykle w komorach bocznych tuż nad hipokampem i jest podobny do drugiego typu, ale zawiera niewiele organelli.
Warstwa IV
Czwarta i ostatnia warstwa (Warstwa IV) służy jako strefa przejściowa między Warstwą III z jej wstęgą astrocytów a miąższem mózgu . Identyfikuje go wysoka obecność mieliny w regionie.
Typy komórek
W SVZ opisano cztery typy komórek:
1. Ciliated Ependymal Cells (Typ E): są umieszczone naprzeciwko światła komory i służą do cyrkulacji płynu mózgowo-rdzeniowego .
2. proliferujących neuroblastów (typ A): wyraźne PSA NCAM ( NCAM1 ) Tuj1 ( TUBB3 ) i Hu i migruje w celu linii na węchowej
3. Wolne proliferacji komórek (B) Typ: wyrazić Nestin i GFAP oraz funkcję ensheathe migracji typ A neuroblastów
4. Aktywnie proliferujące komórki lub tranzytowe komórki progenitorowe (Typ C): wyrażają Nestin i tworzą klastry rozmieszczone między łańcuchami w całym regionie
Funkcjonować
SVZ jest znanym miejscem neurogenezy i samoodnawialnych neuronów w dorosłym mózgu , służącym jako takie z powodu oddziałujących typów komórek, cząsteczek zewnątrzkomórkowych i zlokalizowanej regulacji epigenetycznej promującej taką proliferację komórkową. Wraz z podziarnistej strefy z zakrętu zębatego , strefa okołokomorowa służy jako źródło komórek nerwowych macierzystych (NSC) w procesie dorosłych neurogenezy . Zawiera największą populację proliferujących komórek w mózgach dorosłych gryzoni, małp i ludzi. W 2010 roku wykazano, że równowaga między nerwowymi komórkami macierzystymi a nerwowymi komórkami progenitorowymi (NPC) jest utrzymywana przez interakcję między ścieżką sygnałową receptora naskórkowego czynnika wzrostu a ścieżką sygnałową Notch .
Chociaż funkcja SVZ w mózgu gryzonia nie została jeszcze dogłębnie zbadana w ludzkim mózgu, została do pewnego stopnia zbadana i zdefiniowana pod kątem jej zdolności. Dzięki takim badaniom stwierdzono, że astrocyt o podwójnym działaniu jest dominującą komórką u gryzoni SVZ; ten astrocyt działa nie tylko jako neuronalna komórka macierzysta, ale także jako komórka wspomagająca, która promuje neurogenezę poprzez interakcję z innymi komórkami. Ta funkcja jest również indukowana przez komórki mikrogleju i śródbłonka , które współdziałają z neuronalnymi komórkami macierzystymi w celu promowania neurogenezy in vitro, a także składniki macierzy zewnątrzkomórkowej, takie jak tenascyna-C (pomaga określić granice interakcji) i Lewis X (wiąże czynniki wzrostu i sygnalizacji prekursorów neuronowych). Ludzka SVZ różni się jednak od SVZ gryzoni na dwa różne sposoby; po pierwsze, astrocyty ludzi nie znajdują się w bliskim sąsiedztwie warstwy wyściółki , lecz są oddzielone warstwą pozbawioną ciał komórkowych; drugim jest to, że ludzka SVZ nie ma łańcuchów migrujących neuroblastów obserwowanych u gryzoni SVZ, co z kolei zapewnia mniejszą liczbę komórek neuronalnych u człowieka niż u gryzoni. Z tego powodu, podczas gdy SVZ u gryzoni okazuje się cennym źródłem informacji dotyczących SVZ i jej związku między strukturą a funkcją, model ludzki okaże się znacząco odmienny.
Modyfikacje epigenetycznego DNA odgrywają kluczową rolę w regulacji ekspresji genów podczas różnicowania nerwowych komórek macierzystych . Konwersja cytozyny do 5-metylocytozyny (5mC) w DNA przez metylotransferazę DNA DNMT3A wydaje się być ważnym rodzajem modyfikacji epigenetycznej zachodzącej w SVZ.
Ponadto niektóre aktualne teorie sugerują, że SVZ może również służyć jako miejsce proliferacji komórek macierzystych guza mózgu (BTSC), które są podobne do nerwowych komórek macierzystych pod względem struktury i zdolności do różnicowania się w neurony , astrocyty i oligodendrocyty . Badania potwierdziły, że niewielka populacja BTSC może nie tylko wytwarzać guzy, ale także je utrzymywać dzięki wrodzonej samoodnowie i zdolnościom multipotencjalnym . Chociaż nie pozwala to wnioskować, że BTSC powstają z nerwowych komórek macierzystych, rodzi interesujące pytanie o związek, który istnieje między naszymi własnymi komórkami a tymi, które mogą powodować tak wiele szkód.
Obecne badania
Obecnie istnieje wiele różnych aspektów SVZ, które są badane przez osoby z sektora publicznego i prywatnego. Takie zainteresowania badawcze rozciągają się od roli SVZ w neurogenezie , ukierunkowanej migracji neuronów, do wspomnianej wcześniej nowotworzenia i wielu innych. Poniżej znajdują się podsumowania pracy trzech różnych grup laboratoryjnych, skupiających się przede wszystkim na jednym aspekcie SVZ; obejmują one rolę SVZ w zastępowaniu komórek po uszkodzeniu mózgu, symulację proliferacji NSC oraz rolę w różnych nowotworach nowotworowych.
Rola w wymianie komórek po uszkodzeniu mózgu
W swoim przeglądzie Romanko i in. scharakteryzował wpływ ostrego uszkodzenia mózgu na SVZ. Ogólnie rzecz biorąc, autorzy ustalili, że umiarkowane obrażenia SVZ pozwoliły na powrót do zdrowia, podczas gdy poważniejsze obrażenia spowodowały trwałe szkody w regionie. Ponadto populacja nerwowych komórek macierzystych w obrębie SVZ jest prawdopodobnie odpowiedzialna za tę odpowiedź na uraz.
Wpływ napromieniania na SVZ, który umożliwia rozpoznanie ilości lub dawki promieniowania, które można podać, jest określany głównie przez tolerancję prawidłowych komórek w pobliżu guza . Jak opisano, wzrastająca dawka promieniowania i wiek doprowadziły do zmniejszenia się trzech typów komórek SVZ, jednak zdolność naprawcza SVZ była obserwowana pomimo braku martwicy istoty białej ; nastąpiło to prawdopodobnie dlatego, że SVZ był w stanie stopniowo zastąpić neuroglej w mózgu. Przetestowano również chemioterapeutyki pod kątem ich wpływu na SVZ, ponieważ są one obecnie stosowane w wielu chorobach, ale prowadzą do powikłań w obrębie ośrodkowego układu nerwowego . W tym celu stosowano metotreksat (MTX) sam i w połączeniu z promieniowaniem, aby stwierdzić, że około 70% całkowitej gęstości jądra SVZ zostało wyczerpane, ale biorąc pod uwagę utratę komórek neuroblastów ( komórek progenitorowych ), niezwykłe było odkrycie że NSC SVZ nadal będą generować neurosfery podobne do osób, które nie otrzymały takiego leczenia. W związku z przerwaniem dopływu krwi do mózgu, niedotlenienie / niedokrwienie mózgu (H/I) również zmniejsza liczbę komórek SVZ o 20%, przy czym 50% neuronów w prążkowiu i korze nowej ulega zniszczeniu, ale typy zabitych komórek SVZ były tak niejednorodne jak sam region. Po kolejnych testach stwierdzono, że inna część każdej komórki została wyeliminowana, ale populacja przyśrodkowych komórek SVZ pozostała w większości żywa. Może to zapewnić pewną odporność takich komórek, przy czym niezwiązane komórki progenitorowe działają jako populacja proliferująca po niedokrwieniu . Mechaniczne uszkodzenie mózgu powoduje również migrację i proliferację komórek, co zaobserwowano u gryzoni, a także może zwiększyć liczbę komórek, negując wcześniej utrzymywany pogląd, że nie można wygenerować nowych komórek neuronalnych.
Podsumowując, grupa ta była w stanie ustalić, że komórki w SVZ są w stanie wytwarzać nowe neurony i glej przez całe życie, biorąc pod uwagę, że nie doznają uszkodzeń, ponieważ są wrażliwe na wszelkie szkodliwe skutki. Dlatego SVZ może wyzdrowieć po łagodnym uszkodzeniu i potencjalnie zapewnić zastępczą terapię komórkową w innych dotkniętych obszarach mózgu.
Rola neuropeptydu Y w neurogenezie
Podejmując próbę scharakteryzowania i analizy mechanizmu proliferacji komórek neuronalnych w strefie podkomorowej, Decressac i in. zaobserwowali proliferację prekursorów nerwowych w mysiej strefie podkomorowej poprzez wstrzyknięcie neuropeptydu Y (NPY). NPY jest powszechnie wyrażanym białkiem ośrodkowego układu nerwowego, które, jak wcześniej wykazano, stymuluje proliferację komórek neuronalnych w nabłonku węchowym i hipokampie . W peptydowych Effects s obserwowano przez BrdU znakowania komórek i fenotypowania , że dostarczając dowodów na migrację neuroblastów przez rostralnej strumienia migrujących do węchowej (potwierdza wcześniejsze doświadczenia) i do prążkowia . Takie dane wspierają hipotezę autora, że neurogeneza byłaby stymulowana przez wprowadzenie takiego peptydu .
Ponieważ NPY jest 36- aminokwasowym peptydem związanym z wieloma stanami fizjologicznymi i patologicznymi, ma wiele receptorów, które są szeroko wyrażane w rozwijającym się i dojrzałym mózgu gryzonia. Jednakże, biorąc pod uwagę badania in vivo przeprowadzone przez tę grupę, receptor Y1 wykazywał specyficznie pośredniczone efekty neuroproliferacyjne poprzez indukcję NPY ze zwiększoną ekspresją w strefie podkomorowej. Identyfikacja receptora Y1 rzuca również światło na fakt, że fenotyp komórek ulegających ekspresji z takich zdarzeń mitotycznych jest w rzeczywistości komórkami typu DCX + ( neuroblasty, które migrują bezpośrednio do prążkowia ). Wraz z wpływem wstrzyknięcia NPY na parametry dopaminy w prążkowiu , GABA i glutaminianu w celu regulacji neurogenezy w strefie podkomorowej (poprzednie badanie), odkrycie to jest nadal rozważane, ponieważ może to być wtórny modulator wspomnianych neuroprzekaźników .
Jak jest to konieczne we wszystkich badaniach, grupa ta przeprowadziła swoje eksperymenty z szeroką perspektywą zastosowania swoich odkryć, które, jak twierdzili, mogą potencjalnie przynieść korzyści potencjalnym kandydatom do endogennej naprawy mózgu poprzez stymulację proliferacji nerwowych komórek macierzystych strefy podkomorowej. Ta naturalna molekularna regulacja neurogenezy dorosłych byłaby w połączeniu z terapiami odpowiednimi cząsteczkami, takimi jak testowany receptor NPY i Y1, oprócz pochodnych farmakologicznych , w dostarczaniu możliwych do opanowania postaci zaburzeń neurodegeneracyjnych obszaru prążkowia.
Jako potencjalne źródło guzów mózgu
Próbując scharakteryzować rolę strefy podkomorowej w potencjalnej nowotworzenia , Quinones-Hinojosa i in. odkryli, że komórki macierzyste guza mózgu (BTSC) to komórki macierzyste, które można wyizolować z guzów mózgu za pomocą podobnych testów stosowanych w przypadku neuronalnych komórek macierzystych. Tworząc sfery klonalne podobne do neurosfer neuronalnych komórek macierzystych, te BTSC były zdolne do różnicowania się w neurony , astrocyty i oligodendrocyty in vitro , ale co ważniejsze, zdolne do inicjowania nowotworów przy niskich stężeniach komórek, zapewniając zdolność do samoodnowy. Zaproponowano zatem, aby niewielka populacja BTSC o takich zdolnościach do samoodnawiania utrzymywała guzy w chorobach takich jak białaczka i rak piersi .
Kilka charakterystycznych czynników prowadzi do proponowanej koncepcji neuronalnych komórek macierzystych (NSC) będących źródłem BTSC, ponieważ mają one kilka cech wspólnych. Te cechy są pokazane na rysunku.
Ta grupa dostarcza dowodów na widoczną rolę SVZ w onkogenezie, jak wykazano przez posiadanie receptorów mitogennych i ich odpowiedź na stymulację mitogenną, w szczególności komórki typu C, które wyrażają receptor naskórkowego czynnika wzrostu (EGFR), czyniąc je wysoce proliferacyjnym i inwazyjnym. Ponadto stwierdzono, że istnienie mikrogleju i komórek śródbłonka w SVZ wzmacnia neurogenezę , jak również zapewnia ukierunkowaną migrację neuroblastów z SVZ.
Ostatnio ludzka SVZ została scharakteryzowana u pacjentów z nowotworem mózgu na poziomie fenotypowym i genetycznym. Dane te ujawniają, że u połowy pacjentów SVZ jest dokładnym miejscem nowotworzenia, podczas gdy u pozostałych pacjentów reprezentuje obszar naciekowy. Jest zatem wyraźnie możliwe, że u ludzi istnieje związek między generacją NSC regionu a konsekwentnie samoodnawiającymi się komórkami guzów pierwotnych, które po usunięciu lub napromieniowaniu ustępują miejsca guzom wtórnym.
Chociaż pozostaje do ostatecznego udowodnienia, czy komórki macierzyste SVZ są komórkami pochodzenia guzów mózgu, takich jak glejaki, istnieją mocne dowody sugerujące zwiększoną agresywność nowotworu i śmiertelność u tych pacjentów, u których glejaki wysokiego stopnia naciekają lub stykają się z SVZ.
W raku prostaty neurogeneza indukowana nowotworem charakteryzuje się rekrutacją neuronalnych komórek progenitorowych (NPC) z SVZ. NPC naciekają guz, gdzie różnicują się w neurony autonomiczne (głównie neurony adrenergiczne), które stymulują wzrost guza.