ATP7A - ATP7A
ATP7A , znane również jako białko Menkesa ( MNK ), to transportująca miedź ATPaza typu P, która wykorzystuje energię powstającą w wyniku hydrolizy ATP do transportu Cu(I) przez błony komórkowe. Białko ATP7A jest białkiem transbłonowym i ulega ekspresji w jelicie i wszystkich tkankach z wyjątkiem wątroby. W jelicie ATP7A reguluje wchłanianie Cu(I) w organizmie człowieka poprzez transport Cu(I) z jelita cienkiego do krwi. W innych tkankach ATP7A przemieszcza się między aparatem Golgiego a błoną komórkową, aby utrzymać odpowiednie stężenie Cu(I) (ponieważ w komórce nie ma wolnego Cu(I), jony Cu(I) są ściśle związane) w komórce i dostarcza pewne enzymy z Cu(I) (np. peptydylo-α-monooksygenazę , tyrozynazę i oksydazę lizylową ). Sprzężona z chromosomem X, dziedziczna, letalna choroba genetyczna genu ATP7A powoduje chorobę Menkesa , niedobór miedzi powodujący śmierć we wczesnym dzieciństwie.
Gen
ATP7A gen znajduje się na długim (q) ramienia chromosomu X w Xq21.1 taśmy. Kodowane białko ATP7A ma 1500 aminokwasów. Mutacje/dodatki/delecje tego genu często powodują niedobór miedzi, co prowadzi do postępującej neurodegeneracji i śmierci u dzieci.
Struktura
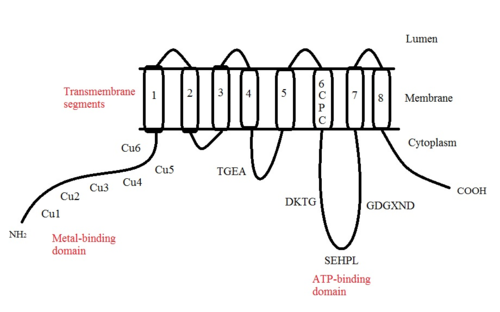
ATP7A jest białkiem transbłonowym z końcami N i C zorientowanymi w kierunku cytozolu (patrz rysunek). Jest wysoce homologiczny do białka ATP7B . ATP7A zawiera trzy główne domeny funkcjonalne:
- Osiem segmentów transbłonowych, które tworzą kanał i umożliwiają przejście Cu(I) przez membranę;
- Domena wiążąca ATP;
- Duża N-końcowa domena cytozolowa, która zawiera sześć powtarzających się miejsc wiązania Cu(I), z których każde zawiera motyw GMTCXXC.
Wiele motywów w strukturze ATP7A jest zachowanych:
- Motyw TGEA leży w pętli po stronie cytozolowej między segmentami przezbłonowymi 4 i 5 i bierze udział w przenoszeniu energii.
- Motyw CPC zlokalizowany w segmencie transbłonowym 6 jest wspólny dla wszystkich ATPaz transportujących metale ciężkie.
Pomiędzy segmentami transbłonowymi 6 i 7 znajduje się duża pętla cytoplazmatyczna, w której znajdują się trzy motywy: DKTG, SEHPL i GDGXND.
- Motyw DKTG jest niezbędny do prawidłowego funkcjonowania ATPazy. Kwas asparaginowy (D) pozostałość fosforylacji podczas cykli transportowych.
- Motyw SEHPL występuje tylko w ATPazach typu P transportujących metale ciężkie. Bez reszty histydyny (H) ATP7A może nie działać prawidłowo.
- Uważa się, że motyw GDGXND w pobliżu segmentu transbłonowego 7 zawiera głównie α-helisy i służy jako wsparcie strukturalne.
Sześć miejsc wiążących Cu(I) na końcu N wiąże po jednym Cu(I). To miejsce wiązania nie jest specyficzne dla Cu(I) i może wiązać różne jony metali przejściowych. Cd(II), Au(III) i Hg(II) wiążą się z miejscem wiązania mocniej niż Zn(II), natomiast Mn(II) i Ni(II) mają mniejsze powinowactwo w stosunku do Zn(II). W przypadku Cu(I) obserwuje się możliwy mechanizm kooperacyjnego wiązania . Gdy stężenie Cu(I) jest niskie, Cu(I) ma mniejsze powinowactwo do ATP7A w porównaniu do Zn(II); wraz ze wzrostem stężenia Cu(I) obserwuje się dramatycznie rosnące powinowactwo Cu(I) do białka.
Zmiana konformacyjna
Dwie reszty cysteiny (C) w każdym miejscu wiązania Cu(I) są skoordynowane z Cu(I) z kątem S-Cu(I)-S pomiędzy 120 a 180° i odległością Cu-S 2,16 Å. Wyniki eksperymentalne z homologicznym białkiem ATP7B sugerują, że zaangażowane są odczynniki redukujące, a po związaniu Cu(I) wiązanie dwusiarczkowe między resztami cysteiny zostaje zerwane, ponieważ cysteina zaczyna wiązać się z Cu(I), co prowadzi do szeregu zmian konformacyjnych na N-końca białka i prawdopodobnie aktywuje aktywność transportującą Cu(I) innych pętli cytozolowych.
Z sześciu miejsc wiązania miedzi(I) dwa są uważane za wystarczające do pełnienia funkcji transportu Cu(I). Powód, dla którego istnieje sześć stron wiążących, nie jest w pełni zrozumiały. Jednak niektórzy naukowcy zaproponowali, że pozostałe cztery miejsca mogą służyć jako detektor stężenia Cu(I).
Mechanizm transportowy
ATP7A należący do rodziny transportera zwanych ATPazy typu P , które katalizują auto fosforylacji klucza konserwowane kwas asparaginowy (D) pozostałość w enzymie. Pierwszym krokiem jest wiązanie ATP z domeną wiążącą ATP i wiązanie Cu(I) z regionem transbłonowym. Następnie ATP7A ulega fosforylacji w kluczowej reszcie kwasu asparaginowego (D) w wysoce konserwatywnym motywie DKTG, czemu towarzyszy uwalnianie Cu(I). Kolejna defosforylacja półproduktu kończy cykl katalityczny. W każdym cyklu ATP7A dokonuje wzajemnej konwersji między co najmniej dwiema różnymi konformacjami, E1 i E2. W stanie E1, Cu(I) jest ściśle związany z miejscami wiązania po stronie cytoplazmatycznej; w stanie E2 powinowactwo ATP7A do Cu(I) maleje i Cu(I) jest uwalniane po stronie zewnątrzkomórkowej.
Funkcjonować
ATP7A jest ważny dla regulacji miedzi Cu(I) u ssaków. Białko to znajduje się w większości tkanek, ale nie ulega ekspresji w wątrobie. W jelicie cienkim białko ATP7A pomaga kontrolować wchłanianie Cu(I) z pożywienia. Po wchłonięciu jonów Cu(I) do enterocytów , ATP7A jest wymagane do przeniesienia ich przez błonę podstawno - boczną do krążenia.
W innych narządach i tkankach białko ATP7A pełni podwójną rolę i przemieszcza się między dwoma lokalizacjami w komórce. Białko normalnie znajduje się w strukturze komórkowej zwanej aparatem Golgiego , która modyfikuje i transportuje nowo wytworzone enzymy i inne białka. Tutaj ATP7A dostarcza Cu(I) do pewnych enzymów (np. peptydylo-α-monooksygenazy , tyrozynazy i oksydazy lizylowej ), które są krytyczne dla struktur i funkcji mózgu, kości, skóry, włosów, tkanki łącznej i układu nerwowego. Jeśli jednak poziom Cu(I) w środowisku komórki jest podwyższony, ATP7A przemieszcza się do błony komórkowej i eliminuje nadmiar Cu(I) z komórki.
Funkcje ATP7A w niektórych tkankach ludzkiego ciała są następujące:
| Papierowa chusteczka | Lokalizacja | Funkcjonować |
|---|---|---|
| Nerka | Wyrażany w komórkach nabłonka proksymalnego i dystalnego kanalika nerkowego | Usuwa nadmiar Cu(I) w celu utrzymania poziomu Cu(I) w nerkach |
| Miąższ | W cytotrofoblastu , syncytiotrofoblaście i płodów naczyniowych śródbłonka komórek | Dostarcza Cu(I) do łożyskowych miedzioenzymów i transportuje Cu(I) do krążenia płodowego |
| Ośrodkowy układ nerwowy | Różne lokalizacje | Dystrybuuje Cu(I) w różnych przedziałach ośrodkowego układu nerwowego |
Interakcje
Wykazano, że ATP7A oddziałuje z ATOX1 i GLRX . Do utrzymania homeostazy miedzi Cu(I) w komórce wymagany jest antyoksydant opiekuńczy miedzi 1 (ATOX1). Może wiązać i transportować cytozolową Cu(I) do ATP7A w sieci trans aparatu Golgiego. Glutaredoksyna-1 (GRX1) ma również zasadnicze znaczenie dla funkcjonowania ATP7A. Promuje wiązanie Cu(I) do późniejszego transportu poprzez katalizowanie redukcji mostków dwusiarczkowych. Może również katalizować de- glutationylacji reakcji C (cysteina) pozostałości w sześciu Cu (I) -binding motywów GMTCXXC.
Znaczenie kliniczne
Choroba Menkesa jest spowodowana mutacjami w genie ATP7A. Naukowcy zidentyfikowali różne mutacje ATP7A, które powodują chorobę Menkesa i zespół rogu potylicznego (OHS), łagodniejszą postać choroby Menkesa. Wiele z tych mutacji usuwa część genu i przewiduje się, że wytwarzają skrócone białko ATP7A, które nie jest w stanie transportować Cu(I). Inne mutacje wstawiają dodatkowe pary zasad DNA lub używają niewłaściwych par zasad, co prowadzi do białek ATP7A, które nie działają prawidłowo.
Zmienione białka, które powstają w wyniku mutacji ATP7A, upośledzają wchłanianie miedzi z pożywienia, nie dostarczają miedzi do niektórych enzymów lub utknęły w błonie komórkowej, niezdolne do przemieszczania się tam iz powrotem z aparatu Golgiego. W wyniku zaburzonej aktywności białka ATP7A miedź jest słabo dystrybuowana do komórek organizmu. Miedź gromadzi się w niektórych tkankach, takich jak jelito cienkie i nerki, podczas gdy w mózgu i innych tkankach występuje niezwykle niski poziom. Zmniejszona podaż miedzi może zmniejszyć aktywność wielu enzymów zawierających miedź, które są niezbędne do budowy i funkcjonowania kości, skóry, włosów, naczyń krwionośnych i układu nerwowego. Miedź ma również kluczowe znaczenie dla propagacji białek prionowych , a myszy z mutacjami w Atp7a mają opóźniony początek choroby prionowej. Udostępniono obszerne zasoby klinicznie adnotowanych wariantów genetycznych w genie ATP7A, potwierdzając wytyczne American College of Medical Genetics and Genomics dotyczące interpretacji wariantów sekwencji.
Zahamowanie
Wykazano, że inhibitor pompy protonowej, omeprazol, blokuje ATP7A, oprócz jego bardziej ustalonej roli blokowania ATP4A.
Bibliografia
Dalsza lektura
- Barnes N, Tsivkovskii R, Tsivkovskaia N, Łucenko S (2005). „Transportujące miedź ATPazy, białka menkesa i choroby Wilsona odgrywają różne role w dorosłym i rozwijającym się móżdżku” . J Biol Chem . 280 (10): 9640–5. doi : 10.1074/jbc.M413840200 . PMID 15634671 .
- Greenough M, Pase L, Voskoboinik I, Petris MJ, O'Brien AW, Camakaris J (2004). „Sygnały regulujące handel Menkesa (MNK; ATP7A) ATPazy typu P przenoszącej miedź w spolaryzowanych komórkach MDCK”. Am J Physiol Cell Physiol . 287 (5): C1463-71. doi : 10.1152/ajpcell.00179.2004 . PMID 15269005 .
- Møller LB, Tümer Z, Lund C, Petersen C, Cole T, Hanusch R, Seidel J, Jensen LR, Horn N (2000). „Podobne mutacje splice-site genu ATP7A prowadzą do różnych fenotypów: klasycznej choroby Menkesa lub zespołu rogu potylicznego” . Am J Hum Genet . 66 (4): 1211–20. doi : 10.1086/302857 . PMC 1288188 . PMID 10739752 .
- Voskoboinik I, Camakaris J (2002). „Menkes miedź-translokująca ATPaza typu P (ATP7A): właściwości biochemiczne i biologii komórki oraz rola w chorobie Menkesa”. J Bioenergia Biomembr . 34 (5): 363-71. doi : 10.1023/A: 1021250003104 . PMID 12539963 . S2CID 23109512 .
- Harris ED, Reddy MC, Qian Y, Tiffany-Castiglioni E, Majumdar S, Nelson J (1999). „Wiele form Menkes Cu-ATPazy”. Transport miedzi i jego zaburzenia . Przysł. Do potęgi. Med. Biol . Postępy w medycynie eksperymentalnej i biologii. 448 . s. 39–51. doi : 10.1007/978-1-4615-4859-1_4 . Numer ISBN 978-1-4613-7204-2. PMID 10079814 .
- Cox DW, Moore SD (2003). „Miedź transportująca ATPazy typu P i choroby u ludzi”. J. Bioenergia. Bioczłon . 34 (5): 333-8. doi : 10.1023/A:1021293818125 . PMID 12539960 . S2CID 21471699 .
- Voskoboinik I, Camakaris J (2003). „Menkes miedź translokująca ATPaza typu P (ATP7A): właściwości biochemiczne i biologii komórki oraz rola w chorobie Menkesa”. J. Bioenergia. Bioczłon . 34 (5): 363-71. doi : 10.1023/A: 1021250003104 . PMID 12539963 . S2CID 23109512 .
- La Fontaine S, Mercer JF (2007). „Przemyt miedzi-ATPaz, ATP7A i ATP7B: rola w homeostazie miedzi”. Łuk. Biochem. Biofizyka . 463 (2): 149–67. doi : 10.1016/j.abb.2007.04.021 . PMID 17531189 .
- Łucenko S, LeShane ES, Shinde U (2007). "Biochemiczne podstawy regulacji ludzkich ATP-paz transportujących miedź" . Łuk. Biochem. Biofizyka . 463 (2): 134–48. doi : 10.1016/j.abb.2007.04.013 . PMC 2025638 . PMID 17562324 .
- Dierick HA, Ambrosini L, Spencer J, Glover TW, Mercer JF (1996). „Struktura molekularna genu choroby Menkesa (ATP7A)”. Genomika . 28 (3): 462–9. doi : 10.1006/geno.1995.1175 . PMID 7490081 .
- Tümer Z, Vural B, Tønnesen T, Chelly J, Monako AP, Horn N (1995). „Charakterystyka struktury egzonowej genu choroby Menkesa za pomocą wektorowego PCR”. Genomika . 26 (3): 437–42. doi : 10.1016/0888-7543(95)80160-N . PMID 7607665 .
- Kaler SG, Gallo LK, Dumny VK, Percy AK, Mark Y, Segal NA, Goldstein DS, Holmes CS, Gahl WA (1995). „Zespół rogu potylicznego i łagodny fenotyp Menkesa związany z mutacjami miejsca splicingu w locus MNK”. Nat. Genet . 8 (2): 195–202. doi : 10.1038/ng1094-195 . PMID 7842019 . S2CID 12122103 .
- Das S, Levinson B, Whitney S, Vulpe C, Packman S, Gitschier J (1994). „Różnorodne mutacje u pacjentów z chorobą Menkesa często prowadzą do pomijania egzonów” . Jestem. J. Hum. Genet . 55 (5): 883-9. PKW 1918324 . PMID 7977350 .
- Chelly J, Tümer Z, Tønnesen T, Petterson A, Ishikawa-Brush Y, Tommerup N, Horn N, Monako AP (1993). „Izolacja genu kandydującego dla choroby Menkesa, który koduje potencjalne białko wiążące metale ciężkie”. Nat. Genet . 3 (1): 14–9. doi : 10.1038/ng0193-14 . PMID 8490646 . S2CID 205341350 .
- Mercer JF, Livingston J, Hala B, Paynter JA, Begy C, Chandrasekharappa S, Lockhart P, Grimes A, Bhave M, Siemieniak D (1993). „Izolacja częściowego genu kandydata na chorobę Menkesa przez klonowanie pozycyjne”. Nat. Genet . 3 (1): 20–5. doi : 10.1038/ng0193-20 . PMID 8490647 . S2CID 9148871 .
- Vulpe C, Levinson B, Whitney S, Packman S, Gitschier J (1993). „Izolacja genu kandydującego dla choroby Menkesa i dowody, że koduje on ATP-azę transportującą miedź”. Nat. Genet . 3 (1): 7–13. doi : 10.1038/ng0193-7 . PMID 8490659 . S2CID 24883244 .
- Levinson B, Conant R, Schnur R, Das S, Packman S, Gitschier J (1997). „Powtarzający się element w regionie regulatorowym genu MNK i jego delecja u pacjenta z zespołem rogu potylicznego” . Szum. Mol. Genet . 5 (11): 1737–42. doi : 10.1093/hmg/5.11.1737 . PMID 8923001 .
- Yamaguchi Y, Heiny ME, Suzuki M, Gitlin JD (1997). „Charakterystyka biochemiczna i wewnątrzkomórkowa lokalizacja białka choroby Menkesa” . Proc. Natl. Acad. Nauka. Stany Zjednoczone . 93 (24): 14030-5. doi : 10.1073/pnas.93.24.14030 . PKW 19489 . PMID 8943055 .
- Petris MJ, Mercer JF, Culvenor JG, Lockhart P, Gleeson PA, Camakaris J (1997). „Regulowany przez Ligand transport pompy wypływowej ATPazy miedzi typu P Menkesa z aparatu Golgiego do błony plazmatycznej: nowy mechanizm regulowanego transportu” . EMBO J . 15 (22): 6084–95. doi : 10.1002/j.1460-2075.1996.tb00997.x . PMC 452430 . PMID 8947031 .
- Tümer Z, Lund C, Tolshave J, Vural B, Tønnesen T, Horn N (1997). „Identyfikacja mutacji punktowych u 41 niespokrewnionych pacjentów dotkniętych chorobą Menkesa” . Jestem. J. Hum. Genet . 60 (1): 63–71. PMC 1712537 . PMID 8981948 .
- Dierick HA, Adam AN, Escara-Wilke JF, Glover TW (1997). „Immunocytochemiczna lokalizacja białka transportującego miedź Menkesa (ATP7A) do sieci trans aparatu Golgiego” . Szum. Mol. Genet . 6 (3): 409–16. doi : 10.1093/hmg/6.3.409 . PMC 7185191 . PMID 9147644 .
- Ronce N, Moizard MP, Robb L, Toutain A, Villard L, Moraine C (1997). „Przejście C2055T w eksonie 8 genu ATP7A jest związane z przeskakiwaniem eksonu w rodzinie zespołu rogu potylicznego” . Jestem. J. Hum. Genet . 61 (1): 233–8. doi : 10.1016/S0002-9297(07)64297-9 . PMC 1715861 . PMID 9246006 .
- Gitschier J, Moffat B, Reilly D, Wood WI, Fairbrother WJ (1998). „Struktura rozwiązanie czwartej domeny wiążącej metal z ATPazy transportującej miedź Menkesa”. Nat. Struktura. Biol . 5 (1): 47–54. doi : 10.1038/nsb0198-47 . PMID 9437429 . S2CID 172550 .
Linki zewnętrzne
- ATP7A+białko,+człowiek w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- Wpis GeneReviews/NCBI/NIH/UW dotyczący zaburzeń transportu miedzi związanych z ATP7A obejmuje: chorobę Menkesa, zespół rogu potylicznego, dystalną neuropatię ruchową związaną z ATP7A
- Wpisy OMIM dotyczące zaburzeń transportu miedzi związanych z ATP7A
- Karta genetyczna
- Lokalizacja ludzkiego genomu ATP7A i strona szczegółów genu ATP7A w UCSC Genome Browser .