Hemoreologia - Hemorheology
Hemorheology , pisane również haemorheology (z greckiego „αἷμα, haima ” krwi „i reologii , z greckiego ῥέω Rheo ” przepływu "i -λoγία, -logia «studium»), albo reologię krwi , jest badanie właściwości przepływu krwi oraz jego elementy plazmy i komórek . Prawidłowa perfuzja tkanek może nastąpić tylko wtedy, gdy właściwości reologiczne krwi mieszczą się w określonych granicach. Zmiany tych właściwości odgrywają istotną rolę w procesach chorobowych. Lepkość krwi określa lepkość osocza, hematokryt (ułamek objętościowy krwinek czerwonych, który stanowi 99,9% elementów komórkowych) oraz właściwości mechaniczne krwinek czerwonych . Czerwone krwinki mają unikalne mechaniczne zachowanie, które można omówić pod pojęciem odkształcalności erytrocytów i agregacji erytrocytów . Z tego powodu krew zachowuje się jak płyn nienewtonowski . W związku z tym lepkość krwi zmienia się wraz z szybkością ścinania . Krew staje się mniej lepka przy wysokich szybkościach ścinania, tak jak przy zwiększonym przepływie, na przykład podczas ćwiczeń lub szczytowego skurczu . Dlatego krew jest płynem rozrzedzającym się przy ścinaniu . Wręcz przeciwnie, lepkość krwi wzrasta, gdy szybkość ścinania spada wraz ze wzrostem średnicy naczynia lub przy niskim przepływie, na przykład za niedrożnością lub rozkurczem . Lepkość krwi również wzrasta wraz ze wzrostem agregacji krwinek czerwonych.
Lepkość krwi
Lepkość krwi jest miarą odporności krwi na przepływ. Można to również opisać jako gęstość i lepkość krwi. Ta właściwość biofizyczna sprawia, że jest to krytyczny wyznacznik tarcia o ściany naczynia , szybkości powrotu żylnego , pracy wymaganej do pompowania krwi przez serce oraz ilości tlenu transportowanego do tkanek i narządów. Te funkcje układu sercowo-naczyniowego są bezpośrednio związane z oporu naczyniowego , obciążenia wstępnego , obciążenia następczego i perfuzji , odpowiednio.
Głównymi determinantami lepkości krwi są hematokrytu , czerwonych krwinek, komórek odkształcalność , czerwony agregacji krwinek i osocza lepkości. Lepkość osocza zależy od zawartości wody i składników wielkocząsteczkowych , więc te czynniki, które wpływają na lepkość krwi, to stężenie białek osocza i rodzaje białek w osoczu. Niemniej jednak hematokryt ma najsilniejszy wpływ na lepkość krwi pełnej. Wzrost hematokrytu o jedną jednostkę może spowodować do 4% wzrost lepkości krwi. Ten związek staje się coraz bardziej wrażliwy wraz ze wzrostem hematokrytu. Kiedy hematokryt wzrasta do 60 lub 70%, co często ma miejsce w przypadku policytemii , lepkość krwi może być nawet 10 razy większa niż wody, a jej przepływ przez naczynia krwionośne jest znacznie opóźniony z powodu zwiększonego oporu przepływu. Doprowadzi to do zmniejszenia dostarczania tlenu . Inne czynniki wpływające na lepkość krwi to temperatura , gdzie wzrost temperatury powoduje spadek lepkości. Jest to szczególnie ważne w hipotermii , gdzie wzrost lepkości krwi spowoduje problemy z krążeniem krwi.
Znaczenie kliniczne
Wiele konwencjonalnych czynników ryzyka sercowo-naczyniowego zostało niezależnie powiązanych z lepkością krwi pełnej.
| Czynniki ryzyka sercowo-naczyniowego powiązane niezależnie z lepkością krwi pełnej |
|---|
| Nadciśnienie |
| Całkowity cholesterol |
| Cholesterol VLDL |
| Cholesterol LDL |
| Cholesterol HDL (korelacja ujemna) |
| Trójglicerydy |
| Chylomikrony |
| Cukrzyca i insulinooporność |
| Syndrom metabliczny |
| Otyłość |
| Palenie papierosów |
| Męska płeć |
| Wiek |
Anemia może zmniejszyć lepkość krwi, co może prowadzić do niewydolności serca . Ponadto wzrost lepkości osocza koreluje z postępem choroby wieńcowej i tętnic obwodowych .
Poziom normalny
W pascal - s (Pa-s), przy czym lepkość krwi w temperaturze 37 ° C wynosi zwykle 3 x 10 -3 do 4 x 10 -3 , odpowiednio 3 - 4 centy puazów (cP) w centymetr gram drugim układzie jednostek .
Lepkość krwi można mierzyć za pomocą wiskozymetrów zdolnych do pomiaru przy różnych szybkościach ścinania, takich jak wiskozymetr rotacyjny .
Lepkosprężystość krwi
Lepkosprężystość jest właściwością ludzkiej krwi, która wynika przede wszystkim z energii sprężystej, która jest magazynowana podczas deformacji czerwonych krwinek, gdy serce pompuje krew przez ciało. Energia przekazywana do krwi przez serce jest częściowo magazynowana w elastycznej strukturze, inna część jest rozpraszana przez lepkość , a pozostała energia jest magazynowana w ruchu kinetycznym krwi. Kiedy uwzględni się pulsację serca, wyraźnie widać elastyczny reżim. Wykazano, że poprzednia koncepcja krwi jako czysto lepkiego płynu była niewystarczająca, ponieważ krew nie jest zwykłym płynem. Krew można dokładniej opisać jako fluidalną zawiesinę elastycznych komórek (lub zol ).
Czerwone krwinki zajmują około połowy objętości krwi i mają właściwości elastyczne. Ta elastyczna właściwość jest największym czynnikiem wpływającym na lepkosprężyste zachowanie krwi. Duży procent objętości czerwonych krwinek przy normalnym poziomie hematokrytu pozostawia niewiele miejsca na ruch i deformację komórek bez interakcji z sąsiednią komórką. Obliczenia wykazały, że maksymalny procent objętości czerwonych krwinek bez deformacji wynosi 58%, co mieści się w zakresie normalnie występujących poziomów. Ze względu na ograniczoną przestrzeń między czerwonymi krwinkami oczywiste jest, że dla przepływu krwi kluczową rolę będzie odgrywać znacząca interakcja między komórkami. Ta interakcja i tendencja komórek do agregacji jest głównym czynnikiem wpływającym na lepkosprężyste zachowanie krwi. Deformacja i agregacja czerwonych krwinek jest również połączona z wywołanymi przepływem zmianami w ułożeniu i orientacji, jako trzeci główny czynnik w jego lepkosprężystym zachowaniu. Inne czynniki wpływające na lepkosprężyste właściwości krwi to lepkość osocza, skład osocza, temperatura oraz szybkość przepływu lub szybkość ścinania. Razem te czynniki sprawiają, że krew ludzka jest lepkosprężysta , nienewtonowska i tiksotropowa .
Kiedy czerwone krwinki są w spoczynku lub przy bardzo małych szybkościach ścinania, mają tendencję do agregowania i układania się razem w energetycznie korzystny sposób. Przyciąganie przypisuje się naładowanym grupom na powierzchni komórek oraz obecności fibrynogenu i globulin. Ta zagregowana konfiguracja jest układem komórek o najmniejszym stopniu odkształcenia. Przy bardzo małych szybkościach ścinania lepkosprężyste właściwości krwi są zdominowane przez agregację, a odkształcalność komórek jest stosunkowo niewielka. Wraz ze wzrostem szybkości ścinania wielkość agregatów zaczyna się zmniejszać. Wraz z dalszym wzrostem szybkości ścinania, komórki przestawią się i zorientują, aby zapewnić kanały do przechodzenia plazmy i przesuwania się komórek. W tym zakresie szybkości ścinania od niskiej do średniej, komórki poruszają się względem sąsiednich komórek, umożliwiając przepływ. Zmniejsza się wpływ właściwości agregacyjnych na lepkosprężystość i zaczyna wzrastać wpływ odkształcalności krwinek czerwonych. Gdy szybkości ścinania stają się duże, czerwone krwinki rozciągają się lub deformują i dopasowują się do przepływu. Powstają warstwy komórek, oddzielone plazmą, a przepływ jest teraz przypisywany warstwom komórek ślizgających się po warstwach plazmy. Warstwa komórkowa pozwala na łatwiejszy przepływ krwi, dzięki czemu ma zmniejszoną lepkość i zmniejszoną elastyczność. Lepkosprężystość krwi jest zdominowana przez odkształcalność czerwonych krwinek.
Model Maxwella
Model Maxwell dotyczy płynów Maxwell lub materiałów Maxwell . Materiał w modelu Maxwella jest płynem, co oznacza, że zachowuje właściwości ciągłości dla zachowawczych równań: Płyny są podzbiorem faz materii i obejmują ciecze, gazy, plazmy i, do pewnego stopnia, plastyczne ciała stałe. Model Maxwella służy do oszacowania lokalnych konserwatywnych wartości lepkosprężystości za pomocą globalnej miary w całkowitej objętości modelu, która ma być przeniesiona do różnych sytuacji przepływowych. Krew jest złożonym materiałem, w którym różne komórki, takie jak czerwone krwinki, są nieciągłe w osoczu. Ich wielkość i kształt są również nieregularne, ponieważ nie są idealnymi kulami. Co więcej, komplikując kształt objętości krwi, krwinki czerwone nie są identycznie rozmieszczone w objętości próbki krwi, ponieważ migrują z gradientami prędkości w kierunku obszarów o największej prędkości, nazywając słynną reprezentację efektu Fåhræusa-Lindqvista , skupionego lub oddzielnego w opisanym przepływie osłonowym lub czopowym przez Thurstona. Zazwyczaj model Maxwella opisany poniżej jednolicie traktuje materiał (jednolity niebieski kolor) jako doskonale rozprowadzone cząstki płynu w całej objętości (na niebiesko), ale Thurston ujawnia, że pakiety czerwonych krwinek, zatyczki, są bardziej obecne w regionie o dużej prędkości , jeśli y jest kierunkiem wysokości na figurze modelu Maxwella, ( y ~H) i w obszarze mniejszej prędkości znajduje się warstwa wolnych komórek ( y ~0), co oznacza, że faza płynu plazmowego, która odkształca się w modelu Maxwella, jest naprężona zgodnie z wewnętrzną okładziny, które całkowicie wymykają się modelowi analitycznemu Maxwella.
Teoretycznie płyn w modelu Maxwella zachowuje się dokładnie podobnie w każdej innej geometrii przepływu, takiej jak rury, obracające się komórki lub w stanie spoczynku. Ale w praktyce właściwości krwi różnią się w zależności od geometrii i krew okazała się nieodpowiednim materiałem do badania jako płyn w zdrowym rozsądku. Tak więc Model Maxwella podaje trendy, które muszą być uzupełnione w rzeczywistej sytuacji, a następnie model Thurstona w naczyniu w zakresie rozmieszczenia komórek w przepływie osłonowym i tłokowym.
Jeśli weźmiemy pod uwagę małą sześcienną objętość krwi, z siłami działającymi na nią przez pompowanie serca i siły ścinające z granic. Zmiana kształtu sześcianu będzie miała 2 elementy:
- Odkształcenie sprężyste, które można odzyskać i jest magazynowane w strukturze krwi.
- Poślizg związany z ciągłym dopływem energii lepkości .
Gdy siła zostanie usunięta, kostka odzyskałaby częściowo. Odkształcenie sprężyste jest odwrócone, ale poślizg nie. To wyjaśnia, dlaczego część elastyczna jest zauważalna tylko przy niestabilnym przepływie. Przy stałym przepływie poślizg będzie nadal wzrastał, a pomiary siły niezmiennej w czasie będą pomijać wkład elastyczności.
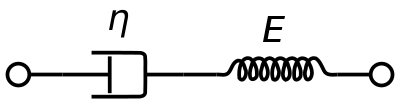
Rysunek 1 można wykorzystać do obliczenia następujących parametrów niezbędnych do oceny krwi, gdy wywierana jest siła.
- Naprężenie ścinające:
- Odkształcenie ścinające:
- Szybkość ścinania:
Przepływ sinusoidalny zmienny w czasie służy do symulacji pulsacji serca. Materiał lepkosprężysty poddany zmiennemu w czasie przepływowi spowoduje zmianę fazy między i reprezentowaną przez . Jeśli , materiał jest czysto elastyczny, ponieważ naprężenia i odkształcenia są w fazie, tak że reakcja jednego wywołana przez drugie jest natychmiastowa. Jeśli = 90°, materiał jest czysto lepki, ponieważ odkształcenie pozostaje w tyle za naprężeniem o 90 stopni. Materiał lepkosprężysty będzie miał temperaturę od 0 do 90 stopni.
Sinusoidalna zmiana czasu jest proporcjonalna do . W związku z tym, wielkość i faza zależność pomiędzy naciskiem, naprężenia, i przy szybkości ścinania są opisane przy użyciu tego związku i radianie częstotliwości były to częstotliwość w hercach .
- Naprężenie ścinające:
- Odkształcenie ścinające:
- Szybkość ścinania:
Składowe złożonego naprężenia ścinającego można zapisać jako:
Gdzie jest naprężenie lepkie i naprężenie sprężyste. Złożony współczynnik lepkości można znaleźć, biorąc stosunek złożonego naprężenia ścinającego i złożonej szybkości ścinania:
Podobnie, złożony moduł dynamiczny G można uzyskać, biorąc stosunek złożonego naprężenia ścinającego do złożonego odkształcenia ścinającego.
Odnosząc równania do wspólnych terminów lepkosprężystych otrzymujemy moduł zachowawczy G' i moduł stratności G".
Wiskoelastyczny model materiału Maxwella jest powszechnie używany do przedstawiania lepkosprężystych właściwości krwi . Wykorzystuje czysto wiskotyczny amortyzator i czysto elastyczną sprężynę połączoną szeregowo. Analiza tego modelu daje złożoną lepkość w postaci stałej kreski i stałej sprężystości.
Model Oldroyda-B
Jednym z najczęściej stosowanych modeli konstytutywnych lepkosprężystości krwi jest model Oldroyda-B. Istnieje kilka odmian nienewtonowskiego modelu Oldroyda-B, charakteryzujących zachowanie ścieńczania spowodowane agregacją i dyspersją czerwonych krwinek przy niskiej szybkości ścinania. Rozważamy tutaj trójwymiarowy model Oldroyda-B w połączeniu z równaniem pędu i tensorem naprężeń całkowitych. Stosowany jest przepływ nienewtonowski, który zapewnia, że lepkość krwi jest funkcją średnicy naczynia d i hematokrytu h. W modelu Oldroyda-B zależność pomiędzy tensorem naprężeń stycznych B a tensorem naprężeń orientacyjnych A wyraża się wzorem:
gdzie D/Dt jest pochodną materiału, V jest prędkością płynu, C1, C2, g są stałymi. S i B są zdefiniowane w następujący sposób:
Lepkosprężystość czerwonych krwinek
Czerwone krwinki poddawane są intensywnej stymulacji mechanicznej zarówno ze strony przepływu krwi, jak i ścian naczyń, a ich właściwości reologiczne mają istotne znaczenie dla ich skuteczności w pełnieniu funkcji biologicznych w mikrokrążeniu. Wykazano, że same czerwone krwinki wykazują właściwości lepkosprężyste. Istnieje kilka metod wykorzystywanych do badania mechanicznych właściwości czerwonych krwinek, takich jak:
- aspiracja mikropipety
- mikro wcięcie
- pęseta optyczna
- testy deformacji elektrycznych wysokiej częstotliwości,
Metody te pozwoliły scharakteryzować odkształcalność czerwonych krwinek pod względem ścinania, zginania, modułów rozszerzania obszaru i czasów relaksacji. Nie byli jednak w stanie zbadać właściwości lepkosprężystych. Wdrożono inne techniki, takie jak pomiary fotoakustyczne. Ta technika wykorzystuje jednoimpulsową wiązkę lasera do generowania sygnału fotoakustycznego w tkankach i mierzy czas zaniku sygnału. Zgodnie z teorią liniowej lepkosprężystości czas zaniku jest równy stosunkowi lepkości do sprężystości, dzięki czemu można było uzyskać charakterystykę lepkosprężystości krwinek czerwonych.
Inna eksperymentalna technika stosowana do oceny lepkosprężystości polegała na użyciu kulek ferromagnetycznych związanych z powierzchnią komórek. Następnie na kulkę magnetyczną przykłada się siły za pomocą optyczno-magnetycznej cytometrii skręcającej, co pozwoliło naukowcom zbadać zależne od czasu reakcje czerwonych krwinek.
jest mechanicznym momentem obrotowym na jednostkę objętości ściegu (jednostki naprężenia) i wyraża się wzorem:
gdzie H jest przyłożonym magnetycznym polem skręcającym, jest kątem momentu magnetycznego kulki w stosunku do pierwotnego kierunku namagnesowania, a c jest stałą kulki, którą wyznacza się w eksperymentach przeprowadzonych przez umieszczenie kulki w płynie o znanej lepkości i zastosowanie skręcania pole.
Złożony moduł dynamiczny G może być użyty do przedstawienia relacji między naprężeniem oscylacyjnym a odkształceniem:
gdzie jest moduł zachowawczy i jest modułem stratności :
gdzie i są amplitudami naprężeń i odkształceń oraz jest przesunięciem fazowym między nimi.
Na podstawie powyższych relacji składowe modułu zespolonego są wyznaczane z pętli utworzonej przez porównanie zmiany momentu obrotowego ze zmianą czasu, która w przedstawieniu graficznym tworzy pętlę. W obliczeniach wykorzystywane są granice pętli - d(t) oraz obszar A, ograniczony przez pętlę - d(t), która reprezentuje rozproszenie energii na cykl. Kąt fazowy , moduł zachowawczy G' i moduł stratności G stają się wtedy:
gdzie d jest przemieszczeniem.
Histereza pokazana na rycinie 3 przedstawia lepkosprężystość obecną w czerwonych krwinkach. Nie jest jasne, czy jest to związane z fluktuacjami molekularnymi błony czy aktywnością metaboliczną kontrolowaną przez wewnątrzkomórkowe stężenia ATP . Potrzebne są dalsze badania, aby w pełni zbadać te interakcje i rzucić światło na leżącą u podstaw charakterystykę lepkosprężystych deformacji czerwonych krwinek.
Skutki naczyń krwionośnych
Patrząc na lepkosprężyste zachowanie krwi in vivo , należy również wziąć pod uwagę wpływ na tętnice , naczynia włosowate i żyły . Lepkość krwi ma główny wpływ na przepływ w większych tętnicach, podczas gdy elastyczność, która wynika z elastycznej odkształcalności czerwonych krwinek, ma główny wpływ na tętniczki i naczynia włosowate. Zrozumienie propagacji fal w ścianach tętnic, lokalnej hemodynamiki i gradientu naprężeń ścinających ściany jest ważne dla zrozumienia mechanizmów funkcji sercowo-naczyniowej. Ściany tętnic są anizotropowe i niejednorodne, składają się z warstw o różnych właściwościach biomechanicznych, co bardzo utrudnia zrozumienie mechanicznego wpływu tętnic na przepływ krwi.
Przyczyny medyczne dla lepszego zrozumienia
Z medycznego punktu widzenia, znaczenie badania lepkosprężystych właściwości krwi staje się oczywiste. Wraz z rozwojem protez sercowo-naczyniowych, takich jak zastawki serca i pompy krwi, konieczne jest zrozumienie pulsującego przepływu krwi w złożonych geometriach. Kilka konkretnych przykładów to wpływ lepkosprężystości krwi i jej implikacje dla testowania pulsacyjnych pomp do krwi. Udokumentowano silne korelacje między lepkosprężystością krwi a regionalnym i globalnym mózgowym przepływem krwi podczas krążenia pozaustrojowego.
Doprowadziło to również do opracowania analogu krwi do badania i testowania urządzeń protetycznych. Klasyczny analog gliceryny i wody zapewnia dobrą reprezentację lepkości i efektów bezwładności, ale brakuje mu elastycznych właściwości prawdziwej krwi. Jednym z takich analogów krwi jest wodny roztwór gumy ksantanowej i gliceryny opracowany w celu dopasowania zarówno lepkich, jak i elastycznych składników złożonej lepkości krwi.
Prawidłowe krwinki czerwone są odkształcalne, ale wiele schorzeń, takich jak anemia sierpowata , zmniejsza ich elastyczność, co czyni je mniej odkształcalnymi. Czerwone krwinki o zmniejszonej odkształcalności mają zwiększoną impedancję przepływu, co prowadzi do zwiększenia agregacji czerwonych krwinek i zmniejszenia nasycenia tlenem, co może prowadzić do dalszych powikłań. Obecność komórek o zmniejszonej odkształcalności, jak w przypadku anemii sierpowatej, ma tendencję do hamowania tworzenia warstw osocza i przez pomiar lepkosprężystości można określić ilościowo stopień hamowania.
Historia
We wczesnych pracach teoretycznych krew traktowano jako lepki płyn nienewtonowski. Wstępne badania oceniały krew podczas przepływu stałego, a później przy użyciu przepływu oscylacyjnego. Profesor George B. Thurston z University of Texas po raz pierwszy przedstawił ideę lepkosprężystości krwi w 1972 roku. Wcześniejsze badania, w których analizowano krew w stałym przepływie, wykazały pomijalne właściwości elastyczne, ponieważ reżim sprężystości jest przechowywany we krwi podczas inicjacji przepływu i więc jego obecność jest ukryta, gdy przepływ osiąga stan ustalony. We wczesnych badaniach wykorzystano właściwości znalezione w przepływie stałym, aby uzyskać właściwości w sytuacjach przepływu nieustalonego. Postęp w procedurach i urządzeniach medycznych wymagał lepszego zrozumienia mechanicznych właściwości krwi.
Równania konstytutywne
Zależności między naprężeniem ścinającym a szybkością ścinania dla krwi należy określić doświadczalnie i wyrazić równaniami konstytutywnymi . Biorąc pod uwagę złożone makroreologiczne zachowanie krwi, nie jest zaskakujące, że pojedyncze równanie nie opisuje w pełni wpływu różnych zmiennych reologicznych (np. hematokrytu , szybkości ścinania). Tak więc istnieje kilka podejść do definiowania tych równań, z których niektóre są wynikiem dopasowywania danych eksperymentalnych do krzywej, a inne oparte są na konkretnym modelu reologicznym.
- Model płynu Newtona, w którym ma stałą lepkość przy wszystkich szybkościach ścinania. To podejście jest ważne dla wysokich szybkości ścinania ( ), gdzie średnica naczynia jest znacznie większa niż komórek krwi.
- Model płynu Binghama uwzględnia agregację czerwonych krwinek przy niskich szybkościach ścinania. Dlatego działa jak elastyczna bryła przy progowym poziomie naprężenia ścinającego, znanego jako granica plastyczności .
- Model Einsteina, w którym η 0 jest lepkością newtonowską płynu zawieszającego, „k” jest stałą zależną od kształtu cząstek, a H jest ułamkiem objętościowym zawiesiny zajmowanym przez cząstki. To równanie ma zastosowanie do zawiesin o małym udziale objętościowym cząstek. Einstein wykazał k=2,5 dla cząstek kulistych.
- Model Cassona, w którym „a” i „b” są stałymi; przy bardzo niskich szybkościach ścinania b jest graniczną wytrzymałością na ścinanie. Jednak w przypadku krwi dane eksperymentalne nie mogą być dopasowane dla wszystkich szybkości ścinania za pomocą tylko jednego zestawu stałych „a” i „b”, podczas gdy dość dobre dopasowanie jest możliwe przez zastosowanie równania dla kilku zakresów szybkości ścinania, a tym samym uzyskanie kilku zestawów stałych.
- Model Quemady, w którym k 0 , k ∞ i γ c są stałymi. To równanie dokładnie pasuje do danych krwi w bardzo szerokim zakresie szybkości ścinania.
Inne cechy
Efekt Fåhraeusa
Stwierdzenie, że dla krwi płynącej równomiernie w rurkach o średnicy mniejszej niż 300 mikrometrów, średni hematokryt krwi w rurce jest mniejszy niż hematokryt krwi w zbiorniku zasilającym rurkę, jest znane jako efekt Fåhræusa. Efekt ten jest generowany na długości wejścia stężenia do rurki, w której erytrocyty przemieszczają się w kierunku centralnego obszaru rurki, gdy przepływają w dół. Szacuje się, że ta długość wejścia odpowiada odległości, jaką krew pokonuje w ciągu ćwierć sekundy dla krwi, w której agregacja krwinek czerwonych jest pomijalna, a średnica naczynia jest większa niż około 20 mikrometrów.
Efekt Fåhræusa-Lindqvista
Gdy charakterystyczny wymiar kanału przepływowego zbliża się do wielkości cząstek w zawiesinie; należy się spodziewać, że prosty continuum model zawieszenia nie będzie miał zastosowania. Często ta granica stosowalności modelu kontinuum zaczyna objawiać się przy charakterystycznych wymiarach kanału, które są około 30 razy większe od średnicy cząstki: w przypadku krwi o charakterystycznym wymiarze RBC 8 μm, pozorna awaria występuje przy około 300 mikrometrach . Wykazali to Fåhraeus i Lindqvist, którzy stwierdzili, że pozorna lepkość krwi była funkcją średnicy rurki dla średnic 300 mikrometrów i mniejszych, gdy przepływała przez rurkę krew o stałym hematokrycie z dobrze wymieszanego zbiornika. Stwierdzenie, że w przypadku małych rurek o średnicy poniżej około 300 mikrometrów i przy szybszych przepływach, które nie pozwalają na znaczną agregację erytrocytów, efektywna lepkość krwi zależy od średnicy rurki, jest znane jako efekt Fåhræusa-Lindqvista.
Zobacz też
- Alfred L. Copley , naukowiec, który wprowadził termin hemoreologia.
- Krwawy młot
- Bioreologia , badanie właściwości płynięcia (reologia) płynów biologicznych.
- Hemodynamika
- Zespół nadlepkości
- Rouleaux to konfiguracja, którą przyjmują agregaty RBC.


























![S+\gamma \left[{\frac {DS}{Dt}}-\Delta V\cdot SS\cdot {(\Delta V)}^{T}\right]=\mu (h,d)\left[ B+\gamma \left({\frac {DB}{Dt}}-\Delta V\cdot BB\cdot {(\Delta V)}^{T}\right)\right]-gA+C_{1}\ lewo(gA-{\frac {C_{2}I}{\mu (h,d)^{2}}}\prawo)](https://wikimedia.org/api/rest_v1/media/math/render/svg/3831dced9bb1d3f7ab7e680931a46882db0817cd)





















