Potencjał płyty końcowej - End-plate potential
Potencjały płytki końcowej ( EPP ) to napięcia powodujące depolaryzację włókien mięśni szkieletowych wywołaną przez neuroprzekaźniki wiążące się z błoną postsynaptyczną w złączu nerwowo-mięśniowym . Nazywa się je „płytkami końcowymi”, ponieważ postsynaptyczne zakończenia włókien mięśniowych mają duży, podobny do spodka wygląd. Gdy potencjał działania osiąga aksonu o neuronu ruchowego , pęcherzyki przenoszenia neuroprzekaźników (przede wszystkim acetylocholina ) są exocytosed a zawartość jest uwalniana do węzła nerwowo-mięśniowej. Te neuroprzekaźniki wiążą się z receptorami na błonie postsynaptycznej i prowadzą do jej depolaryzacji. W przypadku braku potencjału czynnościowego pęcherzyki acetylocholinowe spontanicznie przedostają się do połączenia nerwowo-mięśniowego i powodują bardzo małe depolaryzacje błony postsynaptycznej. Ta niewielka odpowiedź (~0,4 mV) nazywana jest potencjałem miniaturowej płytki końcowej (MEPP) i jest generowana przez jeden pęcherzyk zawierający acetylocholinę. Reprezentuje najmniejszą możliwą depolaryzację, jaką można wywołać w mięśniu.
Połączenie nerwowo-mięśniowe
Połączenie nerwowo-mięśniowe to synapsa, która powstaje między neuronem ruchowym alfa (α-MN) a włóknem mięśni szkieletowych. Aby mięsień się skurczył, potencjał czynnościowy jest najpierw propagowany w dół nerwu, aż osiągnie koniec aksonu neuronu ruchowego. Następnie neuron ruchowy unerwia włókna mięśniowe, powodując skurcz, wywołując potencjał czynnościowy na błonie postsynaptycznej połączenia nerwowo-mięśniowego.
Acetylocholina
Potencjały płytki końcowej są wytwarzane prawie w całości przez neuroprzekaźnik acetylocholinę w mięśniu szkieletowym. Acetylocholina jest drugim po glutaminianie najważniejszym neuroprzekaźnikiem pobudzającym w organizmie . Kontroluje system somatosensoryczny, który obejmuje zmysł dotyku, wzroku i słuchu. Był to pierwszy neuroprzekaźnik zidentyfikowany w 1914 roku przez Henry'ego Dale'a . Acetylocholina jest syntetyzowana w cytoplazmie neuronu z choliny i acetylo-CoA . Acylotransferaza cholinowa to enzym, który syntetyzuje acetylocholinę i jest często używany jako marker w badaniach związanych z produkcją acetylocholiny. Neurony wykorzystujące acetylocholinę nazywane są neuronami cholinergicznymi i są bardzo ważne w skurczu mięśni, pamięci i uczeniu się.
Kanały jonowe
Polaryzacja membran jest kontrolowana przez kanały jonowe sodowe , potasowe , wapniowe i chlorkowe . Istnieją dwa typy kanałów jonowych zaangażowane w połączenie nerwowo-mięśniowe i potencjał płytki końcowej: kanał jonowy bramkowany napięciem i kanał jonowy bramkowany ligandem . Kanały jonowe bramkowane napięciem reagują na zmiany napięcia membrany, które powodują otwarcie kanału jonowego bramkowanego napięciem i przepuszczanie pewnych jonów. Kanały jonowe bramkowane ligandem reagują na pewne cząsteczki, takie jak neuroprzekaźniki. Wiązanie liganda z receptorem na białku kanału jonowego powoduje zmianę konformacyjną, która umożliwia przechodzenie pewnych jonów.
Błona presynaptyczna
Normalnie spoczynkowy potencjał błonowy neuronu ruchowego jest utrzymywany na poziomie od -70 mV do -50 z wyższym stężeniem sodu na zewnątrz i wyższym stężeniem potasu wewnątrz. Kiedy potencjał czynnościowy rozchodzi się w dół nerwu i dociera do końcówki aksonu neuronu ruchowego, zmiana napięcia błony powoduje otwarcie kanałów jonowych bramkowanych napięciem wapnia, umożliwiając napływ jonów wapnia. Te jony wapnia powodują, że pęcherzyki acetylocholiny przyłączone do błony presynaptycznej uwalniają acetylocholinę poprzez egzocytozę do szczeliny synaptycznej.
Membrana postsynaptyczna
EPP są spowodowane głównie przez wiązanie acetylocholiny z receptorami w błonie postsynaptycznej. Istnieją dwa różne rodzaje receptorów acetylocholiny: nikotynowe i muskarynowe. Receptory nikotynowe są kanałami jonowymi bramkowanymi ligandami, które zapewniają szybką transmisję. Wszystkie receptory acetylocholiny w połączeniu nerwowo-mięśniowym są nikotynowe. Receptory muskarynowe są receptorami sprzężonymi z białkiem G , które używają drugiego przekaźnika. Receptory te są powolne i dlatego nie są w stanie zmierzyć potencjału miniaturowej płytki końcowej (MEPP). Znajdują się one w przywspółczulnym układzie nerwowym, takim jak nerw błędny i przewód pokarmowy . Podczas rozwoju płodowego receptory acetylocholiny są skoncentrowane na błonie postsynaptycznej, a cała powierzchnia zakończenia nerwowego w rosnącym zarodku jest pokryta jeszcze przed uruchomieniem sygnału. Pięć podjednostek składających się z czterech różnych białek z czterech różnych genów składa się na nikotynowe receptory acetylocholiny, dlatego ich pakowanie i składanie jest bardzo skomplikowanym procesem z wieloma różnymi czynnikami. Enzym kinaza specyficzna dla mięśni (MuSK) inicjuje procesy sygnalizacyjne w rozwijającej się postsynaptycznej komórce mięśniowej. Stabilizuje klastry postsynaptycznych receptorów acetylocholiny, ułatwia transkrypcję genów synaptycznych przez jądra włókien mięśniowych i powoduje różnicowanie stożka wzrostu aksonów do zróżnicowanego zakończenia nerwowego. Lamina substratu indukuje zaawansowane dojrzewanie skupisk receptorów acetylocholiny na powierzchni miotubul.
Inicjacja
Pęcherzyki synaptyczne
Wszystkie neuroprzekaźniki są uwalniane do szczeliny synaptycznej poprzez egzocytozę z pęcherzyków synaptycznych . Istnieją dwa rodzaje pęcherzyków neuroprzekaźników: duże, gęste pęcherzyki rdzeniowe i małe, przezroczyste pęcherzyki rdzeniowe . Duże, gęste pęcherzyki rdzenia zawierają neuropeptydy i duże neuroprzekaźniki, które są tworzone w ciele komórki neuronu, a następnie transportowane szybkim transportem aksonów do zakończenia aksonu. Małe, przezroczyste pęcherzyki rdzeniowe transportują drobnocząsteczkowe neuroprzekaźniki, które są syntetyzowane lokalnie w zakończeniach presynaptycznych. Sfinalizowane pęcherzyki neuroprzekaźników są związane z błoną presynaptyczną. Kiedy potencjał czynnościowy rozchodzi się w dół aksonu neuronu ruchowego i dociera do zakończenia aksonu, powoduje depolaryzację zakończenia aksonu i otwiera kanały wapniowe. Powoduje to uwolnienie neuroprzekaźników poprzez egzocytozę pęcherzyków.
Po egzocytozie pęcherzyki są poddawane recyklingowi w procesie znanym jako cykl pęcherzyków synaptycznych. Odzyskane błony pęcherzyków przechodzą przez kilka przedziałów wewnątrzkomórkowych, gdzie są modyfikowane w celu wytworzenia nowych pęcherzyków synaptycznych. Są one następnie przechowywane w rezerwowej puli, dopóki nie będą ponownie potrzebne do transportu i uwolnienia neuroprzekaźników.
W przeciwieństwie do puli rezerwowej, łatwo uwalniana pula pęcherzyków synaptycznych jest gotowa do aktywacji. Wyczerpywanie się pęcherzyków z łatwo uwalnialnej puli występuje podczas stymulacji o wysokiej częstotliwości o długim czasie trwania i zmniejsza się wielkość wywołanej EPP. Ta depresja nerwowo-mięśniowa jest spowodowana mniejszym uwalnianiem neuroprzekaźników podczas stymulacji. Aby wyczerpanie nie wystąpiło, musi istnieć równowaga między uzupełnianiem a wyczerpaniem, które może wystąpić przy niskich częstotliwościach stymulacji, poniżej 30 Hz.
Kiedy pęcherzyk uwalnia swoje neuroprzekaźniki poprzez egzocytozę, opróżnia całą swoją zawartość do szczeliny synaptycznej. Stwierdzono zatem, że uwalnianie neuroprzekaźników z pęcherzyków jest kwantowe, ponieważ można uwolnić tylko całkowitą liczbę pęcherzyków. W 1970 roku Bernard Katz z Uniwersytetu Londyńskiego otrzymał Nagrodę Nobla w dziedzinie fizjologii lub medycyny za statystyczne określenie wielkości kwantowej pęcherzyków acetylocholiny na podstawie analizy szumu w połączeniu nerwowo-mięśniowym. Korzystając z książki o statystyce mechanicznej, był w stanie wywnioskować wielkość poszczególnych zdarzeń zachodzących w tym samym czasie.
Pęcherzyki synaptyczne acetylocholiny są przezroczystymi pęcherzykami synaptycznymi rdzenia o średnicy 30 nm. Każdy pęcherzyk acetylocholiny zawiera około 5000 cząsteczek acetylocholiny. Pęcherzyki uwalniają całą swoją ilość acetylocholiny, co powoduje pojawienie się miniaturowych potencjałów płytki końcowej (MEPP), których amplituda jest mniejsza niż 1 mV i nie wystarcza do osiągnięcia wartości progowej.
Miniaturowe potencjały płytki końcowej (MEPP)
Potencjały miniaturowej płytki końcowej to małe (~ 0,4 mV) depolaryzacje terminala postsynaptycznego spowodowane uwolnieniem pojedynczego pęcherzyka do szczeliny synaptycznej. Pęcherzyki neuroprzekaźników zawierające acetylocholinę zderzają się samoistnie z zakończeniem nerwowym i uwalniają acetylocholinę do połączenia nerwowo-mięśniowego nawet bez sygnału z aksonu. Te małe depolaryzacje nie wystarczają do osiągnięcia progu, a zatem potencjał czynnościowy w błonie postsynaptycznej nie występuje. Podczas eksperymentów z MEPP zauważono, że często pojawiają się spontaniczne potencjały czynnościowe, zwane kolcami płytki końcowej w normalnych mięśniach poprzecznie prążkowanych bez żadnego bodźca. Uważano, że kolce płytki końcowej powstały w wyniku urazu lub podrażnienia włókien mięśniowych przez elektrody . Ostatnie eksperymenty wykazały, że kolce w płytce końcowej są w rzeczywistości powodowane przez wrzeciona mięśniowe i mają dwa różne wzory: mały i duży. Wypustki na małej płytce końcowej mają ujemny początek bez propagacji sygnału, a impulsy na dużej płytce końcowej przypominają potencjały jednostki motorycznej (MUP). Wrzeciona mięśniowe to receptory czuciowe, które mierzą wydłużenie lub rozciąganie mięśni i przekazują informacje do rdzenia kręgowego lub mózgu w celu uzyskania odpowiedniej odpowiedzi.
Potencjał progowy („Wszystkie lub żadne”)
Gdy potencjał czynnościowy powoduje uwolnienie wielu pęcherzyków acetylocholiny, acetylocholina dyfunduje przez połączenie nerwowo-mięśniowe i wiąże się z receptorami nikotynowymi bramkowanymi ligandami (nieselektywnymi kanałami kationowymi) na włóknie mięśniowym. Pozwala to na zwiększony przepływ jonów sodu i potasu, powodując depolaryzację sarkolemy (błony komórek mięśniowych). Mała depolaryzacja związana z uwalnianiem acetylocholiny z pojedynczego pęcherzyka synaptycznego nazywana jest miniaturowym potencjałem płytki końcowej (MEPP) i ma wielkość około +0,4 mV. MEPP są addytywne, ostatecznie zwiększając potencjał płytki końcowej (EPP) od około -100mV do potencjału progowego -60mV, przy którym otwierają się bramkowane napięciem kanały jonowe w błonie postsynaptycznej, umożliwiając nagły przepływ jonów sodu z synapsy i ostry skok depolaryzacji. Ten skok napięcia depolaryzacji wyzwala potencjał czynnościowy, który rozprzestrzenia się w dół błony postsynaptycznej, prowadząc do skurczu mięśni. Należy zauważyć, że EPP nie są potencjałami czynnościowymi, ale wyzwalają potencjały czynnościowe. W normalnym skurczu mięśni uwalnianych jest około 100-200 pęcherzyków acetylocholiny, powodując depolaryzację, która jest 100 razy większa niż w przypadku MEPP. Powoduje to depolaryzację potencjału błony +40mV (100 x 0,4mV = 40mV) od -100mV do -60mV, gdzie osiąga próg.
Fazy potencjału działania
Gdy potencjał błony osiągnie próg, pojawia się potencjał czynnościowy i powoduje ostry skok polaryzacji błony. Istnieje pięć faz potencjału czynnościowego: próg, depolaryzacja, szczyt, repolaryzacja i hiperpolaryzacja.
Próg występuje, gdy suma MEPP osiąga pewien potencjał i indukuje otwarcie kanałów jonowych bramkowanych napięciem. Szybki napływ jonów sodu powoduje, że potencjał błony osiąga ładunek dodatni. Potasowe kanały jonowe działają wolniej niż sodowe kanały jonowe, więc gdy potencjał błonowy zaczyna osiągać szczyt, potasowe kanały jonowe otwierają się i powodują wypływ potasu, aby przeciwdziałać napływowi sodu. W szczycie wypływ potasu jest równy napływowi sodu, a membrana nie zmienia polaryzacji.
Podczas repolaryzacji kanały sodowe zaczynają się dezaktywować, powodując wypływ netto jonów potasu. To powoduje, że potencjał błonowy spada do jej potencjału spoczynkowego -100mV. Hiperpolaryzacja występuje, ponieważ dezaktywacja wolno działających kanałów potasowych trwa dłużej, więc błona przewyższa potencjał spoczynkowy. Stopniowo powraca do potencjału spoczynkowego i jest gotowy na pojawienie się kolejnego potencjału czynnościowego.
Podczas potencjału czynnościowego przed fazą hiperpolaryzacji błona nie reaguje na jakąkolwiek stymulację. Ta niezdolność do indukowania innego potencjału czynnościowego jest znana jako okres bezwzględnej refrakcji. W okresie hiperpolaryzacji błona ponownie reaguje na stymulacje, ale wymaga znacznie większego wkładu, aby wywołać potencjał czynnościowy. Ta faza jest znana jako okres względnej refrakcji.
Po zakończeniu potencjału czynnościowego w połączeniu nerwowo-mięśniowym zużyta acetylocholina jest usuwana ze szczeliny synaptycznej przez enzym acetylocholinoesterazę . Kilka chorób i problemów może być spowodowanych niezdolnością enzymów do usuwania neuroprzekaźników ze szczeliny synaptycznej, co prowadzi do dalszej propagacji potencjału czynnościowego.
Zastosowania kliniczne
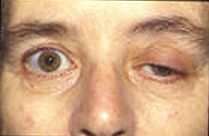
Obecne badania próbują dowiedzieć się więcej o potencjałach płytki końcowej i ich wpływie na aktywność mięśni. Wiele obecnych chorób obejmuje zaburzoną potencjalną aktywność płytki końcowej. U pacjentów z chorobą Alzheimera beta amyloid przyłącza się do receptorów acetylocholiny i hamuje wiązanie acetylocholiny. Powoduje to mniejszą propagację sygnału i małe EPP, które nie osiągają wartości progowej. Analizując procesy mózgowe za pomocą acetylocholiny, lekarze mogą mierzyć ilość beta amyloidu w pobliżu i używać go do oceny jego wpływu na chorobę Alzheimera. Myasthenia gravis jest chorobą autoimmunologiczną, w której organizm wytwarza przeciwciała skierowane przeciwko receptorowi acetylocholiny na błonie postsynaptycznej w połączeniu nerwowo-mięśniowym. Charakterystyczną cechą choroby jest zmęczenie i osłabienie mięśni, pogarszane podczas używania i poprawiane przez odpoczynek. Ze względu na ograniczoną ilość receptorów acetylocholiny, które są dostępne do wiązania, leczenie objawowe polega na zastosowaniu inhibitora acetylocholinesterazy w celu zmniejszenia rozpadu acetylocholiny w połączeniu nerwowo-mięśniowym, tak aby była obecna wystarczająca ilość acetylocholiny dla małej liczby odblokowanych receptorów. Wrodzona nieprawidłowość spowodowana niedoborem acetylocholinowej esterazy w płytce końcowej (AChE) może być patofizjologicznym mechanizmem rozwoju miastenii. W badaniu na pacjencie z niedoborem AChE lekarze zauważyli, że rozwinęło się u niego poważne osłabienie mięśni proksymalnych i tułowia z drganiami innych mięśni. Stwierdzono, że połączenie jittera i szybkości blokowania receptorów acetylocholiny powodowało zmniejszony potencjał płytki końcowej, podobny do obserwowanego w przypadkach miastenii. Badania potencjałów jednostek motorycznych (MUP) doprowadziły do możliwych zastosowań klinicznych w ocenie progresji chorób patologicznych do pochodzenia miogennego lub neurogennego poprzez pomiar związanej ze stałą nieprawidłowością. Potencjały jednostki motorycznej to sygnały elektryczne wytwarzane przez jednostki motoryczne, które można scharakteryzować za pomocą amplitudy, czasu trwania, fazy i wartości szczytowej, a współczynnik nieregularności (IR) jest obliczany na podstawie liczb szczytowych i amplitud. Zespół miasteniczny Lamberta-Eatona jest zaburzeniem, w którym presynaptyczne kanały wapniowe ulegają autoimmunologicznemu zniszczeniu, co powoduje, że mniej pęcherzyków neuroprzekaźników ulega egzocytozie. Powoduje to mniejsze EPP z powodu mniejszej ilości uwalnianych pęcherzyków. Często mniejsze EPP nie osiągają progu, co powoduje osłabienie mięśni i zmęczenie u pacjentów. Wiele zwierząt używa neurotoksyn do obrony i zabijania ofiar. Tetrodotoksyna jest trucizną występującą w niektórych trujących rybach, takich jak rozdymka i rogatnica, która blokuje kanały jonów sodowych i zapobiega potencjalnemu działaniu na błonę postsynaptyczną. Tetraetyloamoniowy występujący w owadach blokuje kanały potasowe. Neurotoksyna alfa występująca w wężach wiąże się z receptorami acetylocholiny i zapobiega wiązaniu acetylocholiny. Alfa-latrotoksyna występująca u pająków czarnej wdowy powoduje ogromny napływ wapnia na końcu aksonu i prowadzi do nadmiernego uwalniania neuroprzekaźników. Toksyna botulinowa wytwarzana przez bakterie Clostridium botulinum jest najsilniejszym białkiem toksycznym. Zapobiega uwalnianiu acetylocholiny na połączeniu nerwowo-mięśniowym poprzez hamowanie dokowania pęcherzyków neuroprzekaźników.
Zobacz też
- Acetylocholina
- Potencjał czynnościowy
- alfa-latrotoksyna
- Choroba Alzheimera
- Toksyna botulinowa
- Neuron ruchowy
- Receptory muskarynowe
- Miastenia gravis
- Połączenie nerwowo-mięśniowe
- Neuroprzekaźnik
- Receptory nikotynowe
- Mięśnie szkieletowe
- pęcherzyk synaptyczny
- Tetraetyloamoniowy
- Tetrodotoksyna