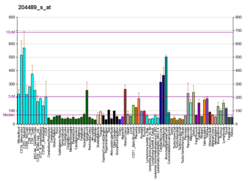
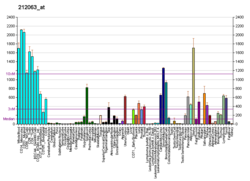
HRAS - HRAS
GTPaza HRas , z „wirusa mięsaka Harvey Rat”, znana również jako białko transformujące p21, jest enzymem, który u ludzi jest kodowany przez gen HRAS . Gen HRAS znajduje się na krótkim (p) ramieniu chromosomu 11 w pozycji 15.5, od pary zasad 522,241 do pary zasad 525,549. HRAS jest małe białko G w Ras podrodziny z Ras nadrodziny z małych GTP . Po związaniu z trifosforanem guanozyny , H- Ras aktywuje kinazę Raf , taką jak c- Raf , kolejny etap szlaku MAPK/ERK .
Funkcjonować
GTPaza HRas bierze udział w regulacji podziału komórek w odpowiedzi na stymulację czynnika wzrostu . Czynniki wzrostu działają poprzez wiązanie receptorów na powierzchni komórki , które obejmują błonę komórkową komórki. Po aktywacji receptory stymulują zdarzenia transdukcji sygnału w cytoplazmie , proces, w którym białka i wtórni posłańcy przekazują sygnały z zewnątrz komórki do jądra komórkowego i nakazują komórce wzrost lub podział. Białko HRAS jest GTPaza i wczesny rolę w wielu szlakach przekazywania sygnałów, i jest zwykle związany z błon komórkowych na skutek obecności izoprenyl grupy na swoim C-końcu . HRAS działa jak molekularny włącznik/wyłącznik, po włączeniu rekrutuje i aktywuje białka niezbędne do propagacji sygnału receptora, takie jak c-Raf i 3-kinaza PI . HRAS wiąże się z GTP w stanie aktywnym i posiada wewnętrzną aktywność enzymatyczną, która rozszczepia końcowy fosforan tego nukleotydu, przekształcając go w GDP . Po konwersji GTP na GDP HRAS jest wyłączony. Szybkość konwersji jest zwykle niska, ale może być znacznie przyspieszona przez dodatkowe białko klasy białek aktywujących GTPazę (GAP), na przykład RasGAP . Z kolei HRAS może wiązać się z białkami klasy Guanine Nucleotide Exchange Factor (GEF), np. SOS1 , co wymusza uwalnianie związanego nukleotydu. Następnie GTP obecny w cytozolu wiąże się, a HRAS-GTP dysocjuje od GEF, powodując aktywację HRAS. HRAS należy do rodziny Ras , która obejmuje również dwa inne protoonkogeny: KRAS i NRAS . Wszystkie te białka są regulowane w ten sam sposób i wydają się znacznie różnić miejscami ich działania w komórce.
Znaczenie kliniczne
Zespół Costello
U osób z zespołem Costello zidentyfikowano co najmniej pięć dziedzicznych mutacji w genie HRAS . Każda z tych mutacji zmienia aminokwas w krytycznym regionie białka HRAS. Najczęstsza mutacja zastępuje aminokwas glicynę aminokwasem seryną w pozycji 12 (zapisanym jako Gly12Ser lub G12S). Mutacje odpowiedzialne za zespół Costello prowadzą do produkcji białka HRAS, które jest stale aktywne. Zamiast wywoływać wzrost komórek w odpowiedzi na określone sygnały z zewnątrz komórki, nadaktywne białko kieruje komórkami do ciągłego wzrostu i podziału. Ten niekontrolowany podział komórek może powodować powstawanie guzów nienowotworowych i rakowych. Naukowcy nie są pewni, w jaki sposób mutacje w genie HRAS powodują inne cechy zespołu Costello (takie jak upośledzenie umysłowe, charakterystyczne rysy twarzy i problemy z sercem), ale wiele oznak i objawów prawdopodobnie wynika z przerostu komórek i nieprawidłowych komórek
Rak pęcherza
Wykazano, że HRAS jest protoonkogenem . Kiedy zmutowana, proto-onkogenów mają potencjał do wywoływania normalne komórki stają się nowotworowe . Niektóre mutacje genów są nabywane w ciągu życia człowieka i są obecne tylko w niektórych komórkach. Zmiany te nazywane są mutacjami somatycznymi i nie są dziedziczone. Mutacje somatyczne w genie HRAS w komórkach pęcherza moczowego są związane z rakiem pęcherza . W znacznym odsetku guzów pęcherza zidentyfikowano jedną konkretną mutację; ta mutacja zastępuje jeden blok budulcowy białka (aminokwas) innym aminokwasem w białku HRAS. W szczególności, mutacja zastępuje aminokwas glicynę od aminokwasu waliny w pozycji 12 (napisany w Gly12Val, G12V, lub H-RasV 12 ). Zmienione białko HRAS jest trwale aktywowane w komórce. To nadaktywne białko kieruje komórką do wzrostu i podziału przy braku zewnętrznych sygnałów, co prowadzi do niekontrolowanego podziału komórek i powstania guza. Mutacje w genie HRAS są również związane z progresją raka pęcherza moczowego i zwiększonym ryzykiem nawrotu guza po leczeniu.
Inne nowotwory
Mutacje somatyczne w genie HRAS są prawdopodobnie zaangażowane w rozwój kilku innych rodzajów raka. Mutacje te prowadzą do białka HRAS, które jest zawsze aktywne i może kierować komórkami do wzrostu i podziału bez kontroli. Ostatnie badania sugerują, że mutacje HRAS są powszechne w raku tarczycy, przewodów ślinowych, raku nabłonkowo-mioepitelialnym i raku nerki. Przyrost liczby kopii DNA segmentu zawierającego HRAS jest zawarty we wzorcu obejmującym cały genom, który, jak stwierdzono, jest skorelowany z wynikiem u pacjenta z gwiaździakiem. Białko HRAS może być również wytwarzane na wyższych poziomach (nadekspresji) w innych typach komórek nowotworowych.
Bibliografia
Dalsza lektura
- McCormick F (grudzień 1995). „Białka związane z ras w transdukcji sygnału i kontroli wzrostu”. Reprodukcja i rozwój molekularny . 42 (4): 500–6. doi : 10.1002/mrd.1080420419 . PMID 8607982 . S2CID 6507743 .
- Ayllon V, Rebollo A (2001). „Zdarzenia komórkowe indukowane przez Ras (przegląd)”. Biologia błon molekularnych . 17 (2): 65-73. doi : 10.1080/09687680050117093 . PMID 10989457 . S2CID 84294021 .
- Tennant RW, Stasiewicz S, Eastin WC, Mennear JH, Spalding JW (2002). „Tg.AC (v-Ha-ras) myszy transgenicznej: charakter modelu”. Patologia toksykologiczna . 29 Suplement (5): 51–9. doi : 10.1080/019262301753178474 . PMID 11695562 . S2CID 20211777 .
- Mascaux C, Iannino N, Martin B, Paesmans M, Berghmans T, Dusart M, Haller A, Lothaire P, Meert AP, Noel S, Lafitte JJ, Sculier JP (styczeń 2005). „Rola onkogenu RAS w przeżyciu chorych na raka płuca: systematyczny przegląd literatury z metaanalizą” . Brytyjski Dziennik Raka . 92 (1): 131–9. doi : 10.1038/sj.bjc.6602258 . PMC 2361730 . PMID 15597105 .
- Harms KL, Chen X (maj 2006). „P19ras wprowadza nowy zwrot w regulacji p73 przez Mdm2”. STKE Nauki . 2006 (337): pe24. doi : 10.1126/stke.3372006pe24 . PMID 16738062 . S2CID 22706614 .
Zewnętrzne linki
- GeneReviews/NCBI/NIH/UW wpis dotyczący zespołu Costello
- HRAS+białko,+człowiek w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)