Przeciwciało przeciwjądrowe - Anti-nuclear antibody
Przeciwciała przeciwjądrowe ( ANA , znane również jako czynnik przeciwjądrowy lub ANF ) to autoprzeciwciała , które wiążą się z zawartością jądra komórkowego . U zdrowych osób układ odpornościowy wytwarza przeciwciała przeciwko obcym białkom ( antygenom ), ale nie przeciwko ludzkim białkom ( autoantygeny ). W niektórych przypadkach wytwarzane są przeciwciała przeciwko ludzkim antygenom.
Istnieje wiele podtypów ANA, takich jak przeciwciała anty-Ro , anty-La , anty-Sm , anty-nRNP , anty- Scl- 70 , anty-dsDNA , antyhistonowe , przeciwciała przeciwko kompleksom porów jądrowych , przeciwciała przeciwko centromerom i przeciwciała przeciwko sp100 . Każdy z tych podtypów przeciwciał wiąże się z różnymi białkami lub kompleksami białkowymi w jądrze. Występują w wielu chorobach, w tym w autoimmunizacji , nowotworach i infekcjach , z różną częstością występowania przeciwciał w zależności od schorzenia. Pozwala to na zastosowanie ANA w diagnostyce niektórych zaburzeń autoimmunologicznych, w tym tocznia rumieniowatego układowego , zespołu Sjögrena , twardziny skóry , mieszanej choroby tkanki łącznej , zapalenia wielomięśniowego , zapalenia skórno-mięśniowego , autoimmunologicznego zapalenia wątroby i tocznia polekowego .
Test ANA wykrywa autoprzeciwciała obecne w surowicy krwi danej osoby . Typowe testy stosowane do wykrywania i ilościowego oznaczania ANA to pośrednia immunofluorescencja i test immunoenzymatyczny (ELISA). W immunofluorescencji poziom autoprzeciwciał podaje się jako miano . Jest to najwyższe rozcieńczenie surowicy, przy którym wciąż wykrywalne są autoprzeciwciała. Dodatnie miana autoprzeciwciał w rozcieńczeniu równym lub większym niż 1:160 są zwykle uważane za klinicznie istotne. Dodatnie miana poniżej 1:160 występują u do 20% zdrowej populacji, zwłaszcza osób starszych. Chociaż dodatnie miana wynoszące 1:160 lub wyższe są silnie związane z zaburzeniami autoimmunologicznymi, występują one również u 5% zdrowych osób. Badanie przesiewowe autoprzeciwciał jest przydatne w diagnostyce zaburzeń autoimmunologicznych, a monitorowanie poziomów pomaga przewidzieć postęp choroby. Dodatni wynik testu ANA jest rzadko przydatny, jeśli nie ma innych danych klinicznych lub laboratoryjnych potwierdzających diagnozę.
Odporność i autoimmunizacja
Organizm ludzki posiada wiele mechanizmów obronnych przed patogenami , jednym z nich jest odporność humoralna . Ten mechanizm obronny wytwarza przeciwciała (duże glikoproteiny ) w odpowiedzi na bodziec immunologiczny. Wiele komórek układu odpornościowego są wymagane w tym procesie, w tym limfocyty ( komórki T i komórek B ) i komórek prezentujących antygen . Komórki te koordynują odpowiedź immunologiczną po wykryciu obcych białek ( antygenów ), wytwarzając przeciwciała wiążące się z tymi antygenami. W normalnej fizjologii limfocyty rozpoznające ludzkie białka ( autoantygeny ) albo przechodzą programowaną śmierć komórki ( apoptozę ), albo stają się niefunkcjonalne. Ta samotolerancja oznacza, że limfocyty nie powinny wywoływać odpowiedzi immunologicznej przeciwko ludzkim antygenom komórkowym. Czasami jednak proces ten zaburza się i powstają przeciwciała przeciwko ludzkim antygenom, co może prowadzić do chorób autoimmunologicznych.
Podtypy ANA
ANA znajdują się w wielu zaburzeniach, a także u niektórych zdrowych osób. Zaburzenia te obejmują: układowy toczeń rumieniowaty (SLE), reumatoidalne zapalenie stawów , zespół Sjógrena , twardzina , zapalenie wielomięśniowe , zapalenie skórno-mięśniowe , pierwotną żółciową marskość wątroby , lekowa toczeń , autoimmunologiczne zapalenie wątroby , stwardnienie rozsiane , tocznia , chorobę tarczycy , zespół antyfosfolipidowy , młodzieńcze idiopatyczne zapalenie stawów , łuszczycowe zapalenie stawów , młodzieńcze zapalenie skórno - mięśniowe , idiopatyczna plamica małopłytkowa , zakażenia i nowotwory . Te przeciwciała można podzielić zgodnie z ich specyficznością, a każdy podzbiór ma różne skłonności do określonych zaburzeń.
Ekstrahowalne antygeny jądrowe
Wyodrębnialne antygeny jądrowe (ENA) to grupa autoantygenów, które zostały pierwotnie zidentyfikowane jako cele przeciwciał u osób z zaburzeniami autoimmunologicznymi. Nazywa się je ENA, ponieważ można je ekstrahować z jądra komórkowego za pomocą soli fizjologicznej. ENA składają się z rybonukleoprotein i białek niehistonowych , nazwanych albo nazwiskiem dawcy, który dostarczył prototypową surowicę (Sm, Ro, La, Jo), albo nazwą choroby, w której wykryto przeciwciała (SS- A, SS-B, Scl-70).
Anty-Ro/SS-A i anty-La/SS-B

Przeciwciała anty-Ro i anty-La , znane również odpowiednio jako SS-A i SS-B, są powszechnie spotykane w pierwotnym zespole Sjögrena , zaburzeniu autoimmunologicznym, które atakuje gruczoły zewnątrzwydzielnicze . Obecność obu przeciwciał stwierdza się w 30–60% zespołu Sjögrena, same przeciwciała anty-Ro stwierdza się w 50–70% zespołu Sjögrena i 30% SLE z zajęciem skóry, a przeciwciała anty-La są rzadko wykrywane w izolacji. . Przeciwciała anty-La znajdują się również w SLE; jednak zwykle występuje również zespół Sjögrena. Przeciwciała anty-Ro występują również rzadziej w innych schorzeniach, w tym w autoimmunologicznych chorobach wątroby, celiakii , autoimmunologicznych chorobach reumatycznych, toczniu rumieniowatym noworodka sercowego i zapaleniu wielomięśniowym . W czasie ciąży przeciwciała anty-Ro mogą przenikać przez łożysko i powodować blok serca i toczeń noworodkowy u niemowląt. W zespole Sjögrena przeciwciała anty-Ro i anty-La korelują z wczesnym początkiem, wydłużeniem czasu trwania choroby, powiększeniem ślinianek przyusznych , chorobą poza gruczołową i naciekaniem gruczołów przez limfocyty. Przeciwciała anty-Ro są specyficzne dla składników kompleksu Ro-RNP, składającego się z białek i RNA 45kDa, 52kDa, 54kDa i 60kDa . Białko wiążące DNA /RNA o masie 60 kDa i białko regulatorowe komórek T o masie 52 kDa są najlepiej scharakteryzowanymi antygenami przeciwciał anty-Ro. Łącznie białka te są częścią kompleksu rybonukleoproteinowego (RNP), który wiąże się z hyRNA, hY1-hY5. Antygen La jest 48 kDa czynnikiem terminacji transkrypcji polimerazy III RNA , która wiąże się z kompleksem Ro-RNP.
Mechanizm wytwarzania przeciwciał w zespole Sjögrena nie jest w pełni poznany, ale pewną rolę może odgrywać apoptoza (programowana śmierć komórki) i mimikra molekularna . Antygeny Ro i La ulegają ekspresji na powierzchni komórek ulegających apoptozie i mogą wywołać stan zapalny w obrębie gruczołu ślinowego poprzez interakcję z komórkami układu odpornościowego. Przeciwciała mogą być również wytwarzane poprzez mimikę molekularną, gdzie przeciwciała reagujące krzyżowo wiążą się zarówno z białkami wirusowymi, jak i ludzkimi. Może to nastąpić w przypadku jednego z antygenów, Ro lub La, a następnie może wytworzyć przeciwciała przeciwko innym białkom w procesie znanym jako rozprzestrzenianie się epitopów . Retrowirusowe białko gag wykazuje podobieństwo do białka La i jest proponowane jako możliwy przykład mimikry molekularnej w zespole Sjögrena.
Anty-Sm
Przeciwciała anty-Smith (Anty-Sm) są bardzo specyficznym markerem SLE. Około 99% osób bez SLE nie ma przeciwciał anty-Sm, ale tylko 20% osób z SLE ma przeciwciała. Są one związane z zajęciem ośrodkowego układu nerwowego , chorobą nerek , zwłóknieniem płuc i zapaleniem osierdzia w SLE, ale nie są związane z aktywnością choroby. Antygeny przeciwciał anty-Sm są podstawowymi jednostkami małych jądrowych rybonukleoprotein (snRNP), zwanych A do G i będą wiązać się z snRNP U1, U2, U4, U5 i U6. Najczęściej przeciwciała są specyficzne dla jednostek B, B' i D. Badania molekularne i epidemiologiczne sugerują, że przeciwciała anty-Sm mogą być indukowane przez mimikę molekularną, ponieważ białko wykazuje pewne podobieństwo do białek wirusa Epsteina-Barra .
Anty-nRNP/anty-U1-RNP
Przeciwciała przeciw jądrowej rybonukleoproteinie (anty-nRNP) , znane również jako przeciwciała anty-U1-RNP, występują w 30-40% SLE. Często spotyka się je z przeciwciałami anty-Sm, ale mogą być związane z różnymi powiązaniami klinicznymi. Oprócz SLE, przeciwciała te są silnie związane z mieszaną chorobą tkanki łącznej . Przeciwciała anty-nRNP rozpoznają jednostki rdzeniowe A i C snRNP i dlatego wiążą się głównie z U1-snRNP. Odpowiedź immunologiczna na RNP może być spowodowana prezentacją składników jądrowych na błonie komórkowej w pęcherzykach apoptotycznych. Sugerowano również mimikrę molekularną jako możliwy mechanizm wytwarzania przeciwciał przeciwko tym białkom ze względu na podobieństwo między polipeptydami U1-RNP i polipeptydami wirusa Epsteina-Barra.
Anty-Scl-70/anty-topoizomeraza I
Przeciwciała anty-Scl-70 są powiązane z twardziną . Czułość przeciwciał na twardzinę skóry wynosi około 34%, ale jest wyższa w przypadkach z rozlanym zajęciem skóry (40%) i niższa w przypadku ograniczonego zajęcia skóry (10%). Swoistość przeciwciał wynosi 98% i 99,6% odpowiednio w przypadku innych chorób reumatycznych i zdrowych osób. Oprócz twardziny, przeciwciała te występują u około 5% osób z SLE. Celem antygenowym przeciwciał anty-Scl-70 jest topoizomeraza I .
Anty-Jo-1
Chociaż przeciwciała anty-Jo-1 są często dołączane do ANA, w rzeczywistości są to przeciwciała przeciwko białku cytoplazmatycznemu, syntetazie histydylo-tRNA - syntetazie aminoacylo-tRNA niezbędnej do syntezy tRNA obciążonego histydyną. Są one silnie związane z zapaleniem wielomięśniowym i zapaleniem skórno - mięśniowym i rzadko występują w innych chorobach tkanki łącznej. Około 20-40% zapalenia wielomięśniowego jest dodatnich dla przeciwciał Jo-1, a większość z nich ma śródmiąższową chorobę płuc, markery ludzkiego antygenu leukocytowego (HLA) HLA-DR3 i HLA-DRw52 ; wspólnie znany jako zespół Jo-1.
Anty-dsDNA
Przeciwciała przeciwko dwuniciowemu DNA (anty-dsDNA) są silnie związane z SLE. Są bardzo specyficznym markerem choroby, a niektóre badania cytują prawie 100%. Dane dotyczące czułości wahają się od 25 do 85%. Poziomy przeciwciał anty-dsDNA, znane jako miana, korelują z aktywnością choroby w SLE; wysokie poziomy wskazują na bardziej aktywnego tocznia. Obecność przeciwciał anty-dsDNA jest również powiązana z toczniowym zapaleniem nerek i istnieją dowody, że są one przyczyną. Niektóre przeciwciała anty-dsDNA reagują krzyżowo z innymi antygenami znajdującymi się na błonie podstawnej kłębuszków (GBM) nerki, takimi jak siarczan heparanu , kolagen IV, fibronektyna i laminina . Wiązanie się z tymi antygenami w nerkach może powodować stan zapalny i wiązanie dopełniacza , co prowadzi do uszkodzenia nerek. Wykazano, że obecność wysokiego wiązania DNA i niskich poziomów C3 ma niezwykle wysoką wartość predykcyjną (94%) dla diagnozy SLE. Możliwe jest również, że przeciwciała anty-dsDNA są internalizowane przez komórki, gdy wiążą antygeny błonowe, a następnie są prezentowane na powierzchni komórki. Mogłoby to promować reakcje zapalne limfocytów T w nerkach. Ważne jest, aby zauważyć, że nie wszystkie przeciwciała anty-dsDNA są związane z toczniowym zapaleniem nerek i że inne czynniki mogą spowodować ten symptom przy ich braku. Antygenem przeciwciał anty-dsDNA jest dwuniciowy DNA .
Przeciwciała antyhistonowe
Przeciwciała antyhistonowe znajdują się w surowicy nawet 75–95% osób z toczniem polekowym i 75% z idiopatycznym SLE. W przeciwieństwie do przeciwciał anty-dsDNA w SLE, te przeciwciała nie wiążą dopełniacza. Chociaż najczęściej spotyka się je w toczniu polekowym, można je również znaleźć w niektórych przypadkach SLE, twardziny skóry , reumatoidalnego zapalenia stawów i niezróżnicowanej choroby tkanki łącznej . Wiadomo, że wiele leków powoduje toczeń polekowy i wytwarzają różne cele antygenowe w nukleosomie, które często reagują krzyżowo z kilkoma białkami histonowymi i DNA. Prokainamid powoduje postać tocznia polekowego, który wytwarza przeciwciała do kompleksu histonów H2A i H2B.
Anty-gp210 i anty-p62
Zarówno przeciwciała anty-glikoproteina-210 (anty-gp210), jak i anty-nukleoporyna 62 (anty-p62) są przeciwciałami przeciwko składnikom błony jądrowej i występują w pierwotnej żółciowej marskości wątroby (PBC). Każde przeciwciało jest obecne w około 25-30% PBC. Antygeny obu przeciwciał są składnikami błony jądrowej . gp210 jest białkiem o masie 200 kDa zaangażowanym w zakotwiczanie składników poru jądrowego w błonie jądrowej. Antygen p62 jest kompleksem porów jądrowych o masie 60 kDa.
Przeciwciała antycentromerowe
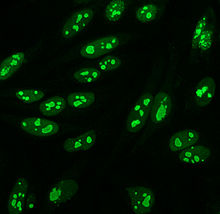
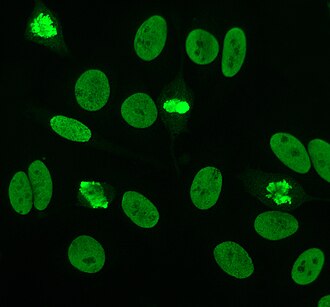
Przeciwciała przeciwko centromerom są związane z ograniczoną skórną twardziną układową, znaną również jako zespół CREST , pierwotną marskością żółciową wątroby i twardziną proksymalną. Istnieje sześć znanych antygenów, z których wszystkie są związane z centromerem ; CENP-A do CENP-F. CENP-A jest białkiem podobnym do histonu H3 o masie 17 kDa. CENP-B jest białkiem wiążącym DNA o masie 80 kDa zaangażowanym w fałdowanie heterochromatyny . CENP-C jest białkiem o masie 140 kDa zaangażowanym w składanie kinetochoru . CENP-D jest białkiem 50 kDa o nieznanej funkcji, ale może być homologiczne do innego białka zaangażowanego w kondensację chromatyny , RCC1 . CENP-E jest białkiem o masie 312 kDa z rodziny kinezyn motorycznych. CENP-F to białko o masie 367 kDa pochodzące z macierzy jądrowej, które łączy się z kinetochorem w późnej fazie G2 podczas mitozy. Najczęściej wykrywane są przeciwciała CENP-A, B i C (16–42% twardziny układowej) i są one związane z objawem Raynauda, teleangiektazjami , zajęciem płuc i wczesnym początkiem twardziny układowej.
Anty-sp100
Przeciwciała anty-sp100 znajdują się w około 20-30% pierwotnej żółciowej marskości wątroby (PBC). Występują u kilku osób bez PBC i dlatego są bardzo specyficznym markerem choroby. Antygen sp100 znajduje się w ciałach jądrowych; duże kompleksy białkowe w jądrze, które mogą odgrywać rolę we wzroście i różnicowaniu komórek.
Anty-PM-Scl
Przeciwciała anty-PM-Scl znajdują się nawet w 50% przypadków zespołu nakładania się zapalenia wielomięśniowego/twardziny układowej (PM/SSc) . Około 80% osób z przeciwciałami obecnymi w surowicy krwi będzie miało zaburzenie. Obecność przeciwciał wiąże się z ograniczonym zajęciem skóry przez zespół nakładania się PM/SSc. Antygenowe docelowe przeciwciał są składnikami RNA mięsu exosome złożone w jąderku . W tym kompleksie znajduje się dziesięć białek, a przeciwciała przeciwko ośmiu z nich występują z różną częstotliwością; PM/Scl-100 (70–80%), PM/Scl-75 (46–80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 ( 10%) i hRrp40 (7%).
Przeciwciała anty-DFS70
Przeciwciała anty-DFS70 generują gęsty, drobno nakrapiany wzór w immunofluorescencji pośredniej i występują u zdrowych osobników iw różnych stanach, ale nie są związane z ogólnoustrojową patologią autoimmunologiczną. W związku z tym można je wykorzystać, aby pomóc wykluczyć takie stany u osób z dodatnim wynikiem ANA. U znacznej liczby pacjentów rozpoznaje się układowy toczeń rumieniowaty lub niezróżnicowaną chorobę tkanki łącznej, w dużej mierze na podstawie dodatniego wyniku ANA. W przypadku, gdy nie można wykryć określonego autoprzeciwciała (np. przeciwciał anty-ENA), zaleca się badanie przeciwciał anty-DFS70 w celu weryfikacji diagnozy. Testy na przeciwciała anty-DFS70 są dostępne jako testy ze znakiem CE. Do tej pory nie jest dostępny test zatwierdzony przez FDA.
Test ANA

Obecność ANA we krwi można potwierdzić badaniem przesiewowym. Chociaż istnieje wiele testów do wykrywania ANA, najczęściej stosowanymi testami do badań przesiewowych są immunofluorescencja pośrednia i test immunoenzymatyczny (ELISA). Po wykryciu ANA określa się różne podtypy.
Pośrednia immunofluorescencja
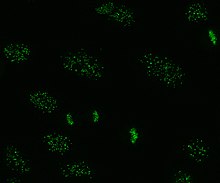
Pośrednia immunofluorescencja jest jednym z najczęściej stosowanych testów na AN. Zazwyczaj jako substrat do wykrywania przeciwciał w ludzkiej surowicy stosuje się komórki HEp-2. Szkiełka mikroskopowe pokrywa się komórkami HEp-2 iz komórkami inkubuje się surowicę. Jeśli wspomniane i ukierunkowane przeciwciała są obecne, zwiążą się one z antygenami na komórkach; w przypadku ANA przeciwciała zwiążą się z jądrem. Można je wizualizować przez dodanie znakowanego fluorescencyjnie (zwykle FITC lub rodopsyny B) przeciwciała anty-ludzkiego, które wiąże się z przeciwciałami. Cząsteczka będzie fluoryzować, gdy pada na nią światło o określonej długości fali, co można zobaczyć pod mikroskopem. W zależności od przeciwciała obecnego w ludzkiej surowicy i lokalizacji antygenu w komórce, na komórkach HEp-2 widoczne będą różne wzory fluorescencji. Poziomy przeciwciał są analizowane przez wykonanie rozcieńczeń na surowicy krwi. Test ANA jest uważany za pozytywny, jeśli obserwuje się fluorescencję przy mianie 1:40/1:80. Wyższe miana są bardziej istotne klinicznie, ponieważ niskie wyniki dodatnie (≤1:160) występują u do 20% zdrowych osób, zwłaszcza osób starszych. Tylko około 5% zdrowej populacji ma miana ANA 1:160 lub wyższe.
HEp-2
Do około 1975 roku, kiedy wprowadzono komórki HEp-2, tkankę zwierzęcą stosowano jako standardowy substrat immunofluorescencji. Komórki HEp-2 są obecnie jednym z najczęstszych substratów do wykrywania ANA metodą immunofluorescencji.
Pierwotnie zapoczątkowany szczep raka krtani, linia komórkowa została skażona i wyparta przez komórki HeLa , a teraz została zidentyfikowana jako faktycznie komórki HeLa.
Przewyższają dotychczas stosowane tkanki zwierzęce ze względu na swój duży rozmiar i wysoki wskaźnik mitozy (podziału komórek) w linii komórkowej . Pozwala to na wykrycie przeciwciał przeciwko antygenom specyficznym dla mitozy, takim jak przeciwciała centromerowe. Pozwalają również na identyfikację przeciwciał anty-Ro, ponieważ do utrwalania komórek używany jest aceton (inne utrwalacze mogą wypłukać antygen).
Istnieje wiele wzorów barwienia jądra komórkowego widocznych na komórkach HEp-2: homogeniczne, plamiste, jąderkowe, błoniaste jądrowe, centromerowe, punktowe jądrowe i pleomorficzne. Jednorodny wzór jest widoczny, gdy skondensowane chromosomy i chromatyna międzyfazowa zabarwiają się. Ten wzór jest powiązany z przeciwciałami anty-dsDNA , przeciwciałami przeciwko składnikom nukleosomalnym i przeciwciałami antyhistonowymi. Istnieją dwa nakrapiane wzory: drobny i gruby. Drobno nakrapiany wzór ma drobne barwienie jąder z niewybarwioną metafazową chromatyną, która jest powiązana z przeciwciałami anty-Ro i anty-La. Zgrubny wzór barwienia charakteryzuje się grubym ziarnistym barwieniem jądra, spowodowanym przez przeciwciała anty-U1-RNP i anty-Sm. Wzór barwienia jąderka jest powiązany z wieloma przeciwciałami, w tym anty-Scl-70, anty-PM-Scl, antyfibrylaryną i anty-Th/To. Barwienie błony jądrowej ma postać pierścienia fluorescencyjnego wokół jądra komórkowego i jest wytwarzane przez przeciwciała anty-gp210 i anty-p62. Wzór centromeru pokazuje wiele punktów jądrowych w komórkach interfazowych i mitotycznych, odpowiadających liczbie chromosomów w komórce. Wzory kropek jądrowych pokazują od 13 do 25 kropek jądrowych w komórkach międzyfazowych i są wytwarzane przez przeciwciała anty- sp100 . Wzór pleomorficzny jest powodowany przez przeciwciała przeciwko jądrowemu antygenowi komórek proliferujących . Wykazano, że pośrednia immunofluorescencja jest nieco lepsza w porównaniu z testem ELISA w wykrywaniu ANA z komórek HEp-2.
Crithidia luciliae
Crithidia luciliae są jednokomórkowymi protistami hemoflagelate . Są używane jako substrat w immunofluorescencji do wykrywania przeciwciał anty-dsDNA. Posiadają organelle znane jako kinetoplast, który jest dużym mitochondrium z siecią zazębiających się kolistych cząsteczek dsDNA. Po inkubacji z surowicą zawierającą przeciwciała anty-dsDNA i znakowane fluorescencyjnie przeciwciała antyludzkie, kinetoplast będzie fluoryzował. Brak innych antygenów jądrowych w tym organelli oznacza, że użycie C. luciliae jako substratu pozwala na specyficzne wykrycie przeciwciał anty-dsDNA.
ELISA
Enzyme-linked immunosorbent assay (ELISA) wykorzystuje płytki do mikromiareczkowania pokryte antygenem do wykrywania ANA. Każda studzienka płytki do mikromiareczkowania jest pokryta albo pojedynczym antygenem, albo wieloma antygenami odpowiednio w celu wykrycia specyficznych przeciwciał lub przeszukiwania pod kątem ANA. Antygeny pochodzą z ekstraktów komórkowych lub są rekombinowane. Surowicę krwi inkubuje się w studzienkach płytki i wypłukuje. Jeśli obecne są przeciwciała wiążące się z antygenem, pozostaną one po umyciu. Dodaje się drugorzędowe przeciwciało antyludzkie skoniugowane z enzymem, takim jak peroksydaza chrzanowa . Reakcja enzymatyczna spowoduje zmianę koloru roztworu proporcjonalną do ilości przeciwciała związanego z antygenem. Istnieją znaczące różnice w wykrywaniu ANA za pomocą immunofluorescencji i różnych zestawów ELISA, a zgodność między nimi jest tylko marginalna. Aby ocenić wyniki różnych testów, klinicysta musi znać różnice.
Wrażliwość
W poniższej tabeli wymieniono wrażliwość różnych typów AN na różne choroby.
| Typ ANA | Antygen docelowy | Wrażliwość (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| SLE | LE wywołany lekami | Rozlana twardzina układowa | Ograniczona twardzina układowa | Zespół Sjögrena | Miopatia zapalna | MCTD | ||
| Wszystkie ANA (według pośredniego IF ) |
Różnorodny | 95 | 100 | 80 | 80 | 70 | 40-60 | 95 |
| Anty-dsDNA | DNA | 60 | – | – | – | 30 | – | - |
| Anty-Sm | Białka rdzeniowe snRNP | 40 | – | – | – | – | – | - |
| Anty-histon | Histony | 60 | 90 | – | – | – | – | - |
| Anty Scl-70 | Topoizomeraza typu I | – | – | 20 | 10 | – | – | - |
| Antycentromer | Białka centromerowe | – | – | 30 | 80 | – | – | - |
| SS-A (Ro) | RNP | 40 | – | – | – | 50 | 10 | - |
| SS-B (La) | RNP | 10-15 | – | – | – | 60–90 | – | |
| – = mniej niż 5% czułości | ||||||||
Niektóre ANA pojawiają się w kilku typach chorób, co skutkuje niższą specyficznością testu. Na przykład wykazano , że IgM- czynnik reumatoidalny (IgM-RF) reaguje krzyżowo z ANA, dając fałszywie dodatnią immunofluorescencję . U pacjentów z autoimmunologiczną chorobą tarczycy zgłaszano obecność przeciwciał ANA oraz przeciwciał anty-DNA . ANA mają pozytywny wynik testu w nie więcej niż 45% osób z autoimmunologicznych tarczycy lub reumatoidalnego zapalenia stawów i do 15% pacjentów z HIV lub zapalenia wątroby typu C . Zgodnie z Lupus Foundation of America „około 5% ogólnej populacji będzie miało pozytywną ANA. Jednak co najmniej 95% osób, które mają pozytywną ANA, nie ma tocznia. Pozytywny test ANA może czasami przebiegać w rodzinach, nawet jeśli członkowie rodziny nie mają dowodów na toczeń”. Z drugiej strony, mówią, chociaż 95% pacjentów, którzy rzeczywiście mają pozytywny wynik testu na obecność ANA, „Tylko niewielki procent ma ujemną ANA, a wielu z nich ma inne przeciwciała (takie jak przeciwciała anty-fosfolipidowe , anty- Ro, anty-SSA) lub ich ANA przekształcone z pozytywnego na negatywny ze steroidów , leków cytotoksycznych lub mocznicy (niewydolność nerek)."
Historia
Komórek LE znaleziono w szpiku kostnym w 1948 roku przez Hargraves et al. W 1957 Holborow i in. po raz pierwszy wykazała ANA przy użyciu pośredniej immunofluorescencji. Była to pierwsza wskazówka, że za SLE odpowiadają procesy zachodzące w jądrze komórkowym. W 1959 r. odkryto, że surowica osób z SLE zawierała przeciwciała, które wytrącały się ekstraktami soli z jąder, znanymi jako ekstrahowalne antygeny jądrowe (ENA). Doprowadziło to do scharakteryzowania antygenów ENA i odpowiadających im przeciwciał. Tak więc przeciwciała anty-Sm i anty-RNP odkryto odpowiednio w 1966 i 1971 roku. W latach 70. odkryto przeciwciała anty-Ro/anty-SS-A i anty-La/anty-SS-B. Wiadomo, że przeciwciało Scl-70 jest swoistym przeciwciałem przeciwko twardzinie w 1979 roku, jednak antygen (topoizomeraza-I) nie został scharakteryzowany do 1986 roku. Antygen i przeciwciało Jo-1 zostały scharakteryzowane w 1980 roku.
Zobacz też
Bibliografia
Linki zewnętrzne
- Autoimmunityblog - Podsumowanie HEp-2 ANA
- Przeciwciała przeciwjądrowe + przeciwciała w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)
- Greidinger, Eric L.; Hoffman, DO; Robert W. (31 stycznia 2003). „Aktualizacja CE [chemia | immunologia]: Testowanie przeciwciał przeciwjądrowych: metody, wskazania i interpretacja” . Medycyna laboratoryjna . 34 (2): 113–117. doi : 10.1309/VUB90VTPMEWV3W0F .