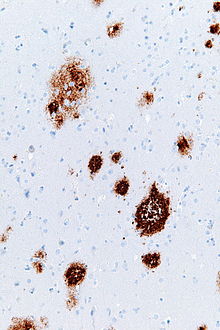
Blaszki amyloidowe - Amyloid plaques
Płytek amyloidowych (znanych również jako płytki neurytyczne , płytek Ap lub starczych blaszek ) są zewnątrzkomórkowe złogi do beta amyloidu (Ap) białek przede wszystkim w istocie szarej mózgu. Zwyrodnieniowe elementy neuronalne oraz obfitość mikrogleju i astrocytów mogą być związane z płytkami amyloidowymi. Niektóre blaszki powstają w mózgu w wyniku starzenia się (starzenia), ale duża liczba blaszek i splątków neurofibrylarnych są charakterystycznymi cechami choroby Alzheimera . Nieprawidłowe neuryty w płytkach amyloidowych są kręte, często nabrzmiałe aksony i dendryty . Neuryty zawierają różnorodne organelle i szczątki komórkowe, a wiele z nich zawiera charakterystyczne sparowane włókna spiralne , ultrastrukturalny składnik splątków neurofibrylarnych. Tabliczki mają bardzo zmienny kształt i rozmiar; w skrawkach tkanek wybarwionych immunologicznie pod kątem Aβ zawierają one krzywą logarytmiczno-normalnego rozkładu wielkości ze średnią powierzchnią płytki 400-450 mikrometrów kwadratowych (µm²). Szczególnie liczne są najmniejsze płytki (poniżej 200 µm²), które często składają się z rozproszonych złogów Aβ. Widoczny rozmiar blaszek zależy od rodzaju barwnika użytego do ich wykrycia oraz od płaszczyzny, przez którą są one cięte do analizy pod mikroskopem. Blaszki tworzą się, gdy Aβ źle się fałduje i agreguje w oligomery i dłuższe polimery , z których te ostatnie są charakterystyczne dla amyloidu . Uważa się, że nieprawidłowo sfałdowany i zagregowany Aβ jest neurotoksyczny , zwłaszcza w stanie oligomerycznym.
Historia
W 1892 Paul Blocq i Gheorghe Marinescu po raz pierwszy opisali obecność blaszek w istocie szarej. Określali blaszki jako „guzki stwardnienia nerwowo-glejowego”. W 1898 roku Emil Redlich zgłosił blaszki miażdżycowe u trzech pacjentów, z których dwóch miało klinicznie potwierdzoną demencję . Redlich użył terminu „stwardnienie prosówkowe” do opisania blaszek, ponieważ sądził, że przypominają nasiona prosa, i jako pierwszy określił zmiany jako „blaszki”. Na początku XX wieku Oskar Fischer zauważył ich podobieństwo do promieniowców „Drusen” (zmiany przypominające geodezy), co skłoniło go do nazwania procesu zwyrodnieniowego „drusige Nekrose”. Aloisowi Alzheimerowi często przypisuje się pierwsze powiązanie blaszek miażdżycowych z demencją w prezentacji z 1906 r. (opublikowanej w 1907 r.), ale ten krótki raport skupiał się głównie na splątkach neurofibrylarnych, a blaszki zostały jedynie krótko wymienione. Pierwszy merytoryczny opis blaszek przez Alzheimera pojawił się w 1911 roku. Z kolei Oskar Fischer opublikował serię obszernych badań blaszek i demencji w latach 1907, 1910 i 1912. W 1911 Max Bielschowsky zaproponował amyloidowy charakter złogów nazębnych. Potwierdził to później Paul Divry, który wykazał, że blaszki zabarwione barwnikiem Congo Red wykazują optyczną właściwość dwójłomności , która jest charakterystyczna dla amyloidów w ogóle. W 1911 roku Teofil Simchowicz wprowadził termin „blaszki starcze” na oznaczenie ich częstej obecności w mózgach osób starszych. W 1968 r. analiza ilościowa przeprowadzona przez Gary'ego Błogosławionego, Bernarda Tomlinsona i Martina Rotha potwierdziła związek blaszek starczych z demencją . Henryk Wiśniewski i Robert Terry ukuli termin „blaszki neurytyczne” w 1973 roku, aby określić blaszki, które obejmują nieprawidłowe procesy neuronalne (neuryty). Ważnym postępem w 1984 i 1985 była identyfikacja Aβ jako białka tworzącego rdzenie łysinek. Odkrycie to doprowadziło do stworzenia nowych narzędzi do badania blaszek miażdżycowych, w szczególności przeciwciał przeciwko Aβ, i stanowiło molekularny cel dla opracowania potencjalnych terapii choroby Alzheimera. Znajomość sekwencji aminokwasowej Aβ umożliwiła również naukowcom odkrycie mutacji genetycznych powodujących autosomalną dominującą chorobę Alzheimera, z których wszystkie zwiększają prawdopodobieństwo agregacji Aβ w mózgu.
Pokolenie amyloidu beta
Amyloid beta (Aβ) to małe białko, najczęściej o długości 40 lub 42 aminokwasów, które jest uwalniane z dłuższego białka macierzystego zwanego białkiem prekursorowym Aβ (APP). APP jest wytwarzany przez wiele typów komórek w ciele, ale szczególnie obficie występuje w neuronach . Jest to jednoprzejściowe białko transbłonowe , czyli jednorazowo przechodzi przez błony komórkowe . Segment Aβ APP znajduje się częściowo w błonie, a częściowo na zewnątrz membrany. Aby uwolnić Aβ, APP jest kolejno rozszczepiany przez dwa enzymy : po pierwsze przez beta-sekretazę (lub enzym rozszczepiający β-amyloid (BACE)) poza błoną, a po drugie przez sekretazę gamma (γ-sekretazę), kompleks enzymatyczny w błonie . Sekwencyjne działanie tych sekretaz powoduje, że fragmenty białka Aβ są uwalniane do przestrzeni zewnątrzkomórkowej. Wyładowanie Aβ jest zwiększane przez aktywność synaps . Oprócz peptydów Aβ, które mają długość 40 lub 42 aminokwasów, generowanych jest również kilka mniej obfitych fragmentów Aβ. Aβ może być chemicznie modyfikowany na różne sposoby, a długość białka i modyfikacje chemiczne mogą wpływać zarówno na jego skłonność do agregacji, jak i jego toksyczność.
Identyfikacja

Blaszki amyloidowe są widoczne pod mikroskopem świetlnym przy użyciu różnych technik barwienia, w tym barwienia srebrem , czerwienią Kongo , tioflawiną , fioletem krezylowym , reakcji PAS i luminescencyjnymi sprzężonymi oligotiofenami (LCO). Metody te często barwią różne składniki blaszek i różnią się pod względem czułości Łysinki można również wizualizować immunohistochemicznie za pomocą przeciwciał skierowanych przeciwko Aβ lub innym składnikom zmian. Barwniki immunohistochemiczne są szczególnie przydatne, ponieważ są zarówno wrażliwe, jak i specyficzne dla antygenów związanych z płytkami.
Kompozycja
Złogi Aβ, które zawierają płytki amyloidowe, mają różną wielkość i wygląd. Pod mikroskopem świetlnym ich rozmiary wahają się od małych, delikatnych nagromadzeń o średnicy kilku mikronów do znacznie większych gęstych lub rozproszonych mas. Tak zwane „klasyczne blaszki” składają się ze zwartego rdzenia Aβ-amyloidowego otoczonego koroną nieco mniej gęsto upakowanego Aβ. Klasyczne blaszki obejmują również nieprawidłowe, nabrzmiałe procesy neuronalne ( neuryty ) pochodzące z wielu różnych typów neuronów, wraz z aktywowanymi astrocytami i mikroglejem . Nieprawidłowe neuryty i aktywowane komórki glejowe nie są typowe dla większości rozlanych blaszek i sugerowano, że rozlane złogi są wczesnym etapem rozwoju blaszek.
Rozkład anatomiczny
Dietmar Thal i jego współpracownicy zaproponowali sekwencję etapów powstawania blaszek w mózgach pacjentów z chorobą Alzheimera. W fazie 1 blaszki pojawiają się w korze nowej ; w fazie 2 pojawiają się w korze alokacji , hipokampie i ciele migdałowatym ; w fazie 3 zajęte są jądra podstawne i międzymózgowie ; w fazie 4 blaszki pojawiają się w śródmózgowiu i rdzeniu przedłużonym ; aw fazie 5 pojawiają się w moście i móżdżku . Tak więc w schyłkowej fazie choroby Alzheimera blaszki można znaleźć w większości części mózgu. Są rzadkie w rdzeniu kręgowym .
Formacja i rozprzestrzenianie się
Prawidłowe funkcjonowanie Aβ nie jest pewne, ale blaszki powstają, gdy białko ulega nieprawidłowemu fałdowaniu i zaczyna gromadzić się w mózgu w procesie szablonowania molekularnego („zaszczepianie”). Mathias Jucker i Lary Walker porównali ten proces do powstawania i rozprzestrzeniania się prionów w chorobach znanych jako gąbczaste encefalopatie lub choroby prionowe . Zgodnie z paradygmatem prionowym, niektóre białka nieprawidłowo fałdują się w kształty, które są bogate w drugorzędową strukturę beta-kartki . W tym stanie powodują, że inne białka tego samego typu przyjmują tę samą nienormalną strukturę bogatą w beta-kartki. Źle sfałdowane białka sklejają się ze sobą, ostatecznie układając się razem, tworząc oligomery, które łączą się ze sobą, tworząc włókienka amyloidu, które są typowe dla dojrzałych płytek.
Zaangażowanie w chorobę
Obfite blaszki Aβ, wraz ze splotami neurofibrylarnymi składającymi się z zagregowanego białka tau , to dwie zmiany wymagane do neuropatologicznej diagnozy choroby Alzheimera. Chociaż liczba splątków neurofibrylarnych silniej koreluje ze stopniem demencji niż liczba blaszek, odkrycia genetyczne i patologiczne wskazują, że Aβ odgrywa kluczową rolę w ryzyku, wystąpieniu i progresji choroby Alzheimera. Szczególnie ważne są dłuższe (42 aminokwasy) rodzaje Aβ znane jako Aβ42. Podwyższone poziomy Aβ, jak również wzrost stosunku Aβ42 do postaci 40-aminokwasowej (Aβ40), są ważnymi wczesnymi zdarzeniami w patogenezie choroby Alzheimera.
Do niedawna diagnoza choroby Alzheimera wymagała mikroskopowej analizy blaszek i splątków w tkance mózgowej, zwykle podczas autopsji. Jednakże płytki Aβ (wraz z mózgową angiopatią Aβ-amyloidową ) można teraz wykryć w mózgach żywych osobników. Odbywa się to poprzez przygotowanie radioznakowanych środków, które po wprowadzeniu do krwiobiegu wiążą się selektywnie ze złogami Aβ w mózgu. Te ligandy przekraczania bariery krew-mózg i dołączyć do zagregowanego Ap i ich zatrzymywanie w mózgu oceniano za pomocą pozytonowej tomografii emisyjnej (PET). Ponadto obecność blaszek i splątków można oszacować, mierząc ilości białek Aβ i tau w płynie mózgowo-rdzeniowym .
Występowanie
Prawdopodobieństwo pojawienia się blaszek w mózgu wzrasta wraz z wiekiem. Od 60. roku życia (10%) do 80. roku życia (60%) odsetek osób z blaszkami starczymi wzrasta liniowo. Kobiety nieco częściej mają płytki nazębne niż mężczyźni. Zarówno blaszki miażdżycowe, jak i choroba Alzheimera są również częstsze u starzejących się osób z trisomią -21 ( zespół Downa ). Uważa się, że wynika to z nadmiernej produkcji Aβ, ponieważ gen APP znajduje się na chromosomie 21, który w zespole Downa występuje w trzech kopiach.
Blaszki amyloidowe naturalnie występują w starzejących się mózgach gatunków innych niż ludzie, od ptaków po małpy człekokształtne. U naczelnych innych niż człowiek, które są najbliższymi biologicznymi krewnymi człowieka, płytki zostały znalezione we wszystkich zbadanych dotychczas gatunkach. Jednak splątki neurofibrylarne są rzadkie i nie wykazano, aby żaden gatunek inny niż człowiek miał demencję wraz z całkowitą neuropatologią choroby Alzheimera.
Badania
Badania zostały ukierunkowane na zrozumienie biochemicznych , cytologicznych i zapalnych cech blaszek miażdżycowych, określenie sposobu powstawania i proliferacji blaszek w mózgu, identyfikację genetycznych i środowiskowych czynników ryzyka, odkrycie metod ich wykrywania w żywym mózgu oraz opracowanie strategii terapeutycznych zapobiegania lub ich usunięcie. Badania nad tworzeniem i proliferacją płytek amyloidowych zostały przyspieszone dzięki opracowaniu genetycznie zmodyfikowanych modeli mysich. Mimo pewnych ograniczeń modele te przyczyniły się również do odkrycia nowych strategii terapeutycznych. Na przykład, za pomocą transgenicznych modeli gryzoni zidentyfikowano rosnącą różnorodność terapii, które zmniejszają poziomy Aβ i liczbę płytek w mózgu . Strategie te obejmują podejścia immunoterapeutyczne i inhibitory sekretaz, które uwalniają Aβ z APP. Takie terapie są obecnie oceniane klinicznie pod kątem leczenia choroby Alzheimera. Dotychczasowe odkrycia wskazują, że usuwanie blaszek miażdżycowych u pacjentów z demencją przynosi niewielkie korzyści, prawdopodobnie dlatego, że mózg jest poważnie uszkodzony przed pojawieniem się pierwszych objawów choroby Alzheimera. Tworzenie płytek za pośrednictwem mikrogleju może w rzeczywistości być korzystne przez kapsułkowanie Aβ w gęstych rdzeniach płytek. Z tego powodu wielu badaczy uważa, że wcześniejsze hamowanie agregacji Aβ i tworzenia blaszek jest potrzebne do spowolnienia lub zapobiegania tauopatii i demencji w chorobie Alzheimera. Inne badania mają na celu zrozumienie stanu zapalnego, który jest często związany z płytkami lub identyfikację środowiskowych, fizjologicznych i genetycznych czynników ryzyka powstawania płytki nazębnej i choroby Alzheimera.
Zobacz też
Bibliografia
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (wrzesień 1991). „Starcze neuryty blaszki miażdżycowej w chorobie Alzheimera gromadzą białko prekursorowe amyloidu” . Materiały Narodowej Akademii Nauk Stanów Zjednoczonych Ameryki . 88 (17): 7552-6. Kod Bib : 1991PNAS...88.7552C . doi : 10.1073/pnas.88.17.7552 . PMC 52339 . PMID 1652752 .
- ^ Purves, Dale; Augustyn, George J.; Fitzpatricka, Dawida; Hall, William C.; LaManita, Anthony-Samuel; Biały, Leonard E.; Mooney, Richard D.; Platt, Michael L. (2012). Neuronauka (wyd. 5). Sunderland, MA: Sinauer Associates. P. 713. Numer ISBN 978-0-87893-695-3.
- ^ B c d Dickson DW (1997). „Patogeneza blaszek starczych” . J Neuropathol Exp Neurol . 56 (4): 321–339. doi : 10.1097/00005072-199704000-00001 . PMID 9100663 .
- ^ a b c d e f g h i j k l m n o Walker LC (2020). „blaszki Aβ” . Darmowa neuropatologia . 1 (31): 31. doi : 10.17879/freeneuropathology-2020-3025 . PMC 7745791 . PMID 33345256 .
- ^ Ballard, C; Gauthier, S; Corbetta, A; Brayne'a, C; Aarsland, D; Jones, E (19 marca 2011). „Choroba Alzheimera”. Lancet . 377 (9770): 1019–31. doi : 10.1016/S0140-6736(10)61349-9 . PMID 21371747 . S2CID 20893019 .
- ^ Hyman BT; Zachodni HL; Rebeck GW; Buldyrev SW; Mantegna RN; Ukleja M; Havlin S; Stanleya ON (1995). „Analiza ilościowa blaszek starczych w chorobie Alzheimera: obserwacja logarytmiczno-normalnego rozkładu wielkości i epidemiologii molekularnej różnic związanych z genotypem apolipoproteiny E i trisomią 21 (zespół Downa)” . Materiały Narodowej Akademii Nauk Stanów Zjednoczonych Ameryki . 92 (8): 3586–3590. Kod Bib : 1995PNAS...92.3586H . doi : 10.1073/pnas.92.8.3586 . PMC 42212 . PMID 7724603 .
- ^ B c Rohr D, Boon BD, et al. (grudzień 2020). „Bezetykietowe obrazowanie oscylacyjne różnych typów blaszek Aβ w chorobie Alzheimera ujawnia sekwencyjne zdarzenia w rozwoju blaszek” . Komunikacja Acta Neuropathologica . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Haassa C; Selkoe DJ (2007). „Rozpuszczalne oligomery białek w neurodegeneracji: lekcje z beta-peptydu amyloidu Alzheimera”. Nat Rev Mol Cell Biol . 8 (2): 101–112. doi : 10.1038/nrm2101 . PMID 17245412 . S2CID 32991755 .
- ^ Blok, Paweł; Marinesco, Georges (1892). Sur les damage et la patogenie de l'epilepsie dite essentielle . s. 445-6. OCLC 492619936 .
- ^ Buda O; Arsen D; Ceausu M; Dermengiu D; Curca GC (styczeń 2009). „Georges Marinesco i wczesne badania w neuropatologii”. Neurologia . 72 (1): 88–91. doi : 10.1212/01.wnl.0000338626.93425.74 . PMID 19122036 . S2CID 45428057 .
- ^ Redlich E (1898). „Ueber miliare Sklerose der Hirnrinde bei senior Atrophie”. Jahrbücher für Psychiatrie und Neurologie . 17 : 208–216.
- ^ B c Goedert M (2009). „Oskar Fischer i badanie demencji” . Mózg . 132 (4): 1102–1111. doi : 10.1093/mózg/awn256 . PMC 2668940 . PMID 18952676 .
- ^ Alzheimer, A (1907). „Uber einen eigenartige Erkranung der Hirnrinde”. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin . 64 : 146-8.
- ^ Divry P (1927). „Etiuda histo-chimique des plaques séniles”. Journal Belge de Neurologie et de Psychiatrie . 9 : 643–657.
- ^ Buxbaum JN; Linke RP (2012). „Molekularna historia amyloidoz”. Czasopismo Biologii Molekularnej . 421 (2–3): 142–159. doi : 10.1016/j.jmb.2012.01.024 . PMID 22321796 .
- ^ Simchowicz T.: Histologische Studien über die senile Demenz. w: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der pathologischen Anatomie der Geisteskrankheiten . Jena: G. Fischer, 1911, s. 267-444.
- ^ Ohry A; Buda O (2015). „Teofil Simchowicz (1879-1957): naukowiec, który ukuł blaszki starcze w neuropatologii”. Rumuński Dziennik Morfologii i Embriologii . 56 (4): 1545–1548. PMID 26743308 .
- ^ Grzybowski A; Pieta A; Pugaczewska M (2017). „Teofil Simchowicz (1879-1957)” . Czasopismo Neurologii . 264 (8): 1831-1832. doi : 10.1007/s00415-017-8460-9 . PMC 5533842 . PMID 28315959 .
- ^ Błogosławiony G; Tomlinson BE; Roth M (1968). „Związek między ilościowymi miarami demencji a starczą zmianą istoty szarej mózgu osób starszych”. Brytyjski Dziennik Psychiatryczny . 114 (512): 797-811. doi : 10.1192/bjp.114.512.797 . PMID 5662937 .
- ^ Wiśniewski, Henryk M.; Terry, Robert D. (1973). „Rozdział 1: Ponowne badanie patogenezy starczej płytki nazębnej”. W Zimmerman, HM (red.). Postęp w neuropatologii, tom 2 . Grune i Stratton. s. 1-26. Numer ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). „Choroba Alzheimera: wstępny raport z oczyszczania i charakterystyki nowego mózgowo-naczyniowego białka amyloidu”. Komunikacja badań biochemicznych i biofizycznych . 120 (3): 885-890. doi : 10.1016/s0006-291x(84)80190-4 . PMID 6375662 .
- ^ Glenner GG; Wong CW (1984). „Choroba Alzheimera i zespół Downa: dzielenie unikalnego białka włókienek amyloidu mózgowo-naczyniowego”. Komunikacja badań biochemicznych i biofizycznych . 122 (3): 1131–1135. doi : 10.1016/0006-291x(84)91209-9 . PMID 6236805 .
- ^ Mistrzowie CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K (1985). „Białko rdzeniowe płytki amyloidowej w chorobie Alzheimera i zespole Downa” . Materiały Narodowej Akademii Nauk USA . 82 (12): 4245–4249. Kod Bib : 1985PNAS...82,4245M . doi : 10.1073/pnas.82.12.4245 . PMC 397973 . PMID 3159021 .
- ^ B c Walsha SM; Selkoe DJ (2020). „Białko beta amyloidu i nie tylko: droga naprzód w chorobie Alzheimera”. Aktualna opinia w neurobiologii . 61 : 116–124. doi : 10.1016/j.conb.2020.02.003 . PMID 32197217 . S2CID 214600892 .
- ^ a b c d e f Długi JM; DM Holtzmana (2019). „Choroba Alzheimera: Aktualizacja Patobiologii i strategii leczenia” . Komórka . 179 (2): 312–339. doi : 10.1016/j.komórka.2019.09.001 . PMC 6778042 . PMID 31564456 .
- ^ Walker LC (2015). „Szczepy proteopatyczne i niejednorodność chorób neurodegeneracyjnych” . Roczny Przegląd Genetyki . 50 : 329–346. doi : 10.1146/annurev-genet-120215-034943 . PMC 6690197 . PMID 27893962 .
- ^ Selkoe, DJ (1999). „Rozdział 19: Biologia białka prekursorowego β-amyloidu i mechanizm choroby Alzheimera”. w Terry, RD; Katzman, R; Bick, KL; Sisodia, SS (red.). Choroba Alzheimera . Lippincott Williams i Wilkins. s. 293-310. Numer ISBN 0-7817-1503-2.
- ^ a b c Haass C; Kaether C; Thinakaran G; Sisodia S (2012). „Przemyt i proteolityczne przetwarzanie APP” . Cold Spring Harbor Perspectives w medycynie . 2 (5:a006270): a006270. doi : 10.1101/cshperspect.a006270 . PMC 3331683 . PMID 22553493 .
- ^ Suh YH; Checler F (wrzesień 2002). „Białko prekursorowe amyloidu, preseniliny i alfa-synukleina: patogeneza molekularna i zastosowania farmakologiczne w chorobie Alzheimera”. Recenzje farmakologiczne . 54 (3): 469-525. doi : 10.1124/pr.54.3.469 . PMID 12223532 . S2CID 86686003 .
- ^ Dunys J; Valverde A; Checler F (2018). „Czy gatunki Aβ skrócone na N- i C-końcu są kluczowymi patologicznymi wyzwalaczami w chorobie Alzheimera?” . Czasopismo Chemii Biologicznej . 293 (40): 15419-15428. doi : 10.1074/jbc.R118.003999 . PMC 6177599 . PMID 30143530 .
- ^ Kummer MP; Heneka MT (2014). „Skrócone i zmodyfikowane gatunki amyloidu beta” . Badania i terapia Alzheimera . 6 (3): 28. doi : 10.1186/alzrt258 . PMC 4055046 . PMID 25031638 .
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). „Porównanie siedmiu metod barwienia blaszek starczych i splotów neurofibrylarnych w prospektywnej serii 15 pacjentów w podeszłym wieku”. Neuropatologia i Neurobiologia Stosowana . 15 (6): 563–78. doi : 10.1111/j.1365-2990.1989.tb01255.x . PMID 2482455 . S2CID 25220224 .
- ^ Klingstedt T; Nilsson KPR (2012). „Luminescencyjne sprzężone poli- i oligo-tiofeny: optyczne ligandy do przypisania spektralnego mnóstwo agregatów białkowych”. Transakcje Towarzystwa Biochemicznego . 40 (4): 704-710. doi : 10.1042/BST20120009 . PMID 22817720 .
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; Wilk R; Bar KJ; Juckel G (grudzień 2011). „Czy rutynowe metody są wystarczająco dobre, aby zabarwić płytki starcze i splątki neurofibrylarne w różnych obszarach mózgu pacjentów z demencją?” (PDF) . Psychiatria Danubina . 23 (4): 334–9. PMID 22075733 . Zarchiwizowane z oryginału (PDF) dnia 2017-08-11 . Pobrano 22.06.2014 .
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). „Etapy procesu patologicznego w chorobie Alzheimera: kategorie wiekowe od 1 do 100 lat” . Czasopismo Neuropatologii i Neurologii Eksperymentalnej . 70 (11): 960-969. doi : 10.1097/NEN.0b013e318232a379 . PMID 22002422 .
- ^ Thal DR; Rub O; Orantes M; Braak H (2002). „Fazy odkładania Abeta w ludzkim mózgu i jego znaczenie dla rozwoju AD”. Neurologia . 58 (12): 1791–1800. doi : 10.1212/wnl.58.12.1791 . PMID 12084879 . S2CID 41133337 .
- ^ Thal DR; Waltera J; Saido TC; Fändricha M (2015). „Neuropatologia i biochemia Aβ i jego agregatów w chorobie Alzheimera” . Acta Neuropathologica . 129 (2): 167–182. doi : 10.1007/s00401-014-1375-y . PMID 25534025 . S2CID 19701015 .
- ^ B Jucker, m; Walker, LC (2013). „Samorozmnażanie się patogennych agregatów białkowych w chorobach neurodegeneracyjnych” . Natura . 501 (7465): 45–51. Kod Bibcode : 2013Natur.501...45J . doi : 10.1038/nature12481 . PMC 3963807 . PMID 24005412 .
- ^ Walker LC; Jucker M (2015). „Choroby neurodegeneracyjne: rozszerzenie koncepcji prionów” . Roczny przegląd neuronauki . 38 : 87-103. doi : 10.1146/annurev-neuro-071714-033828 . PMC 4803040 . PMID 25840008 .
- ^ Prusiner SB (1998). „Priony” . Materiały Narodowej Akademii Nauk USA . 95 (23): 13363–13383. Kod Bib : 1998PNAS...9513363P . doi : 10.1073/pnas.95.23.13363 . PMC 33918 . PMID 9811807 .
- ^ Eisenberg D; Jucker M (2015). „Stan amyloidowy białek w chorobach człowieka” . Komórka . 148 (6): 1188–1203. doi : 10.1016/j.cell.2012.02.022 . PMC 3353745 . PMID 22424229 .
- ^ Nelson PT, Alafuzoff I, Bigio EH, et al. (2012). „Korelacja zmian neuropatologicznych choroby Alzheimera ze stanem poznawczym: przegląd literatury” . Czasopismo Neuropatologii i Neurologii Eksperymentalnej . 71 (5): 362–381. doi : 10.1097/NEN.0b013e31825018f7 . PMC 3560290 . PMID 22487856 .
- ^ B Findeis MA (listopad 2007). „Rola amyloidu beta peptydu 42 w chorobie Alzheimera”. Farmakologia i terapia . 116 (2): 266–86. doi : 10.1016/j.pharmthera.2007.06.006 . PMID 17716740 .
- ^ Thal DR, Ronisz A, Tousseyn T, et al. (2019). „Różne aspekty patologii związanej z chorobą Alzheimera amyloidu β-peptydowego i ich związek z obrazowaniem tomografii emisyjnej amyloidu pozytonowego i otępieniem” . Komunikacja Acta Neuropathologica . 7 (1): 178. doi : 10.1186/s40478-019-0837-9 . PMC 6854805 . PMID 31727169 .
- ^ Mathis CA; Lopresti BJ; Ikonomović MD; Klunk WE (2017). „Drobnocząsteczkowe znaczniki PET do obrazowania proteinopatii” . Seminaria z medycyny nuklearnej . 47 (5): 553-575. doi : 10.1053/j.semnuclmed.2017.06.003 . PMC 5657567 . PMID 28826526 .
- ^ Ritchiego C; Smailagic N; Noel-Storr AH; Ukumunne O; Chłopcy WE; Marcina S (2017). „CSF tau i współczynnik CSF tau/ABeta w diagnostyce otępienia związanego z chorobą Alzheimera i innymi otępieniami u osób z łagodnymi zaburzeniami poznawczymi (MCI)” . Baza danych przeglądów systematycznych Cochrane . 3 (3): CD010803. doi : 10.1002/14651858.CD010803.pub2 . PMC 6464349 . PMID 28328043 .
- ^ Hansson O; Lehmanna S; Otto M; Zetterberg H; Lewczuka P (2019). „Zalety i wady stosowania współczynnika CSF amyloidu beta (Abeta) 42/40 w diagnostyce choroby Alzheimera” . Badania i terapia Alzheimera . 11 (1): 34. doi : 10.1186/s13195-019-0485-0 . PMC 6477717 . PMID 31010420 .
- ^ B linii żeńskiej FC; Wigboldusa JM; Smeuldersa AW (1986). „Zapadalność na starczą amyloidozę mózgu” (PDF) . Patologia - Badania i Praktyka . 181 (5): 558–562. doi : 10.1016/S0344-0338(86)80149-2 . PMID 3786248 .
- ^ Franke, M (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen" . Berlin, Niemcy: Neuropathologische Abteilung. Zarchiwizowane od oryginału w dniu 19.07.2011.
- ^ a b Głowa E; Powella D; Złoty BT; Schmitt FA (2012). „Choroba Alzheimera w zespole Downa” . European Journal of Neurodegenerative Disease . 1 (3): 353–364. PMC 4184282 . PMID 25285303 .
- ^ Heuer E; Rosen RF; Cintron A; Walkera LC (2012). „Modele naczelnych innych niż ludzkie proteopatii mózgowej podobnej do choroby Alzheimera” . Aktualny projekt farmaceutyczny . 18 (8): 1159–1169. doi : 10.2174/138161212799315885 . PMC 3381739 . PMID 22288403 .
- ^ Walker LC; Jucker M (2017). „Wyjątkowa podatność ludzi na chorobę Alzheimera” . Trendy w medycynie molekularnej . 23 (6): 534-545. doi : 10.1016/j.molmed.2017.04.001 . PMC 5521004 . PMID 28483344 .
- ^ Jucker M (2010). „Korzyści i ograniczenia modeli zwierzęcych w badaniach translacyjnych w chorobach neurodegeneracyjnych”. Medycyna przyrodnicza . 16 (11): 1210–1214. doi : 10.1038/nm.2224 . PMID 21052075 . S2CID 30167302 .
- ^ Myers A; McGonigle P (2010). „Przegląd transgenicznych modeli myszy w chorobie Alzheimera”. Aktualne protokoły w neuronauce . 89 (1:e81): 1210–1214. doi : 10.1002/cpns.81 . PMID 31532917 . S2CID 202024310 .
- ^ Huang Y, Happonen KE (kwiecień 2021). „Mikrogleje wykorzystują receptory TAM do wykrywania i pochłaniania blaszek amyloidu β” . Immunologia Przyrody . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Heppner FL; Ransohoffa RM; Bechera B (2015). „Atak immunologiczny: rola stanu zapalnego w chorobie Alzheimera”. Nature Recenzje Neuronauka . 16 (6): 358–372. doi : 10.1038/nrn3880 . PMID 25991443 . S2CID 6116253 .
- ^ De Strooper B; Karran E (2016). „Faza komórkowa choroby Alzheimera” . Komórka . 164 (4): 603–615. doi : 10.1016/j.cell.2015.12.056 . PMID 26871627 .
- ^ Killin LOJ; Gwiazda JM; Shiue IJ; Russ TC (2016). „Środowiskowe czynniki ryzyka demencji: przegląd systematyczny” . BMC Geriatria . 16 (1): 175. doi : 10.1186/s12877-016-0342-y . PMC 5059894 . PMID 27729011 .
Dalsza lektura
- Jellingera KA (2005). "Neurodegeneracyjne Erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF) . Journal für Neurologie, Neurochirurgie und Psychiatrie . 6 (1): 9-18.
- Cruz L, Urbanc B, Buldyrev SV, et al. (lipiec 1997). „Agregacja i dezagregacja blaszek starczych w chorobie Alzheimera” . Materiały Narodowej Akademii Nauk Stanów Zjednoczonych Ameryki . 94 (14): 7612–6. Kod Bibcode : 1997PNAS...94.7612C . doi : 10.1073/pnas.94.14.7612 . PMC 23870 . PMID 9207140 .