Agonista nikotynowy - Nicotinic agonist
Nikotynowy agonista jest lek, który naśladuje działanie acetylocholiny (ACh) w nikotynowych receptorów acetylocholiny (nAChR). Nazwa nAChR pochodzi od jego powinowactwa do nikotyny.
Przykładami są nikotyna (według definicji), acetylocholiny (The endogennym agonistą nAChR), cholina , epibatydyna , lobelinę , wareniklinę i cytyzyny .
Historia
Nikotyna jest znana od wieków ze swojego odurzającego działania. Po raz pierwszy został wyizolowany w 1828 roku z tytoniu przez niemieckich chemików Posselta i Reimanna.
Odkrycie pozytywnego wpływu nikotyny na pamięć zwierząt zostało odkryte podczas badań in vivo w połowie lat osiemdziesiątych XX wieku. Badania te zapoczątkowały nową erę w badaniach nad nikotynowym receptorem acetylocholiny (nAChR) i ich stymulacją, ale do tego czasu koncentrowano się głównie na uzależnieniu od nikotyny. Rozwój agonistów nAChR rozpoczął się we wczesnych latach 90-tych po odkryciu pozytywnych skutków nikotyny. Niektóre badania wykazały możliwą opcję terapii w badaniach przedklinicznych. ABT-418 był jednym z pierwszych z serii agonistów nAChR i został zaprojektowany przez firmę Abbott Labs . ABT-418 wykazał znaczny wzrost wydajności opóźnionego dopasowania do próbki (DMTS) u dojrzałych małp makaków różnych gatunków i płci. ABT-418 badano również jako możliwe leczenie choroby Alzheimera, choroby Parkinsona i zespołu nadpobudliwości psychoruchowej z deficytem uwagi: te eksperymenty dały pozytywne wyniki.
Jednym z pierwszych związków aktywnych nAChR, oprócz nikotyny, który był sprzedawany jako lek, była galantamina , alkaloid roślinny, który działa jako słaby inhibitor cholinoesterazy (IC50 = 5 µM), a także allosteryczny uczulacz na nAChR (EC50 = 50 nM).
Receptory nikotynowe acetylocholiny i ich system sygnalizacji
System sygnalizacji
W ludzkim układzie nerwowym sygnały cholinergiczne nikotynowe rozprzestrzeniają się w całym systemie, gdzie neuroprzekaźnik acetylocholina (ACh) odgrywa kluczową rolę w aktywacji kanałów jonowych bramkowanych ligandami . Układ cholinergiczny jest ważnym szlakiem nerwowym, w którym neurony cholinergiczne syntetyzują, przechowują i uwalniają neuroprzekaźnik ACh. Głównymi receptorami, które konwertują komunikaty ACh, są cholinergiczne muskarynowe receptory acetylocholiny , neuronalne i mięśniowe nAChR. Patrząc wstecz na historię ewolucji, ACh jest uważana za najstarszą cząsteczkę przekaźnika i stała się obecna przed komórką nerwową. W układzie nerwowym stymulacja cholinergiczna za pośrednictwem nAChR kontroluje szlaki, takie jak uwalnianie przekaźników i wrażliwość komórek, które mogą wpływać na aktywność fizjologiczną, w tym sen, niepokój, przetwarzanie bólu i funkcje poznawcze.
Receptory nikotynowe acetylocholiny
nAChR to receptory cholinergiczne występujące w ośrodkowym układzie nerwowym (OUN), obwodowym układzie nerwowym (PNS) i mięśniach szkieletowych. Te receptory są bramkowanymi ligandami kanałami jonowymi z miejscami wiązania acetylocholiny i innych cząsteczek. Kiedy ACh lub inni agoniści wiążą się z receptorami, stabilizuje stan otwarty kanału jonowego, umożliwiając napływ kationów, takich jak jony potasu, wapnia i sodu. Na nAChR składają się różne podjednostki, które określają czwartorzędową strukturę receptora, są to podjednostki α (α1 − α10), podjednostki β (β1 − β4), jedna podjednostka δ, jedna γ i jedna ε. nAChR mogą być heteromeryczne lub homomeryczne . Heteromeryczne receptory występujące w ośrodkowym układzie nerwowym składają się z dwóch podjednostek α i trzech podjednostek β z miejscem wiązania na granicy α i sąsiedniej podjednostki. Te receptory zawierają dwa miejsca wiązania na receptor i mają różne powinowactwo do substancji chemicznych w zależności od składu podjednostek. Oba miejsca wiążące działają razem, a zatem oba miejsca muszą być zajęte przez agonistę nAChR, aby mogła nastąpić aktywacja kanału. Wykazano, że nAChR zawierające podjednostki α2 − α6 i β2 − β4 mają większe powinowactwo do ACh niż inne receptory. Receptory homomeryczne zawierają 5 identycznych podjednostek, mają 5 miejsc wiązania zlokalizowanych na styku dwóch sąsiednich podjednostek. W 2000 roku zidentyfikowano dwa homomeryczne receptory u ludzi, receptory α7 i α8.
Strona wiążąca
Istnieją dwa miejsca wiązania na heteromerycznych nAChR; aby ustabilizować otwartą postać nAChR, oba miejsca wiązania muszą być zajęte przez agonistę, takiego jak nikotyna lub ACh.
Miejsce wiązania ACh w nAChR składa się z sześciu pętli, zwanych A – F. Pętle A, B i C miejsca wiązania są częścią podjednostki α i są głównymi składnikami miejsca wiązania. Sąsiednia podjednostka do podjednostki α (γ, δ, ε lub β) zawiera pętle D, E i F.
Mechanizm akcji
agoniści receptora α4β2
α4β2 nAChR zawierają dwie podjednostki α4 i trzy podjednostki β2, dlatego mają dwa miejsca wiązania dla ACh i innych agonistów . α4β2 nAChR stanowią około 90% nAChR w ludzkim mózgu, a chroniczne narażenie na nikotynę lub innych agonistów nikotyny prowadzi do zwiększenia gęstości receptorów α4β2, co jest przeciwieństwem tego, co zwykle dzieje się, gdy inne receptory są chronicznie narażone na ich agonistów. Receptor α4β2 był szeroko badany pod kątem choroby Alzheimera, a także uzależnienia od nikotyny, aw 2009 roku na rynku pojawiło się kilka leków, które są ukierunkowane konkretnie na α4β2 nAChR.
agoniści receptora α7
Receptory α7 to homomeryczne neuronalne receptory acetylocholiny składające się z pięciu podjednostek α7 i mające pięć miejsc wiązania ACh. Doniesiono, że nieprawidłowości w ekspresji receptorów α7 wpływają na progresję chorób, takich jak choroba Alzheimera i schizofrenia . Uważa się, że α7 nie ma tak dużego powinowactwa do nikotyny jak heteromeryczny receptor, ale zamiast tego wykazało większe powinowactwo do alfa-bungarotoksyny, która jest antagonistą nikotynowym znajdowanym w jadzie niektórych węży. Dlatego uważa się, że celowanie w receptory α7 jest przydatne w leczeniu choroby Alzheimera i schizofrenii.
Agoniści receptorów typu mięśniowego
nAChR znajdują się w połączeniu nerwowo-mięśniowym na mięśniach szkieletowych. Znaleziono dwa różne receptory, z których jeden został znaleziony głównie u dorosłych i zawiera dwie podjednostki α1, jedną β1, jedną ε i jedną δ, a drugi stwierdzono u płodów i zawiera podjednostkę γ zamiast ε. NAChR biorą udział w depolaryzacji płytki końcowej mięśni poprzez zwiększenie przepuszczalności kationów, co prowadzi do skurczu mięśni szkieletowych. NAChR znalezione w układzie mięśni szkieletowych mają dwa miejsca wiązania ACh, z których jedno znajduje się na granicy między podjednostkami α1 i δ, a drugie na granicy między podjednostkami α1 i γ lub ε. Wśród antagonistów nAChR zaprojektowanych specjalnie dla układu nerwowo-mięśniowego są gazy nerwowe i inne trucizny zaprojektowane do szybkiego zabijania ludzi lub innych zwierząt i owadów.
Wiążący
ACh wiąże się z nAChR z powodu różnicy ładunku między cząsteczką a powierzchnią receptora. Podczas wiązania z nAChR ACh mieści się w kieszeni wiążącej ukształtowanej przez pętle A, B i C, które należą do podjednostki α i sąsiedniej podjednostki. Po włożeniu ACh do kieszeni wiążącej pętle nAChR podlegają ruchowi, który prowadzi do koordynacji cząsteczki ACh w kieszeni, wzmacniając wiązania chemiczne między cząsteczką a receptorem. Po przesunięciu pętli, które należą do podjednostki α, czasami cząsteczka ACh może utworzyć wiązanie, np. Mostek solny, z sąsiednią podjednostką, jeszcze bardziej wzmacniając wiązania między receptorem a ACh.
Projekt leku
Leki wpływające na nAChR mogą być agonistami, częściowymi agonistami lub antagonistami . Agoniści, np. Nikotyna, mogą jednak działać jako środki depolaryzujące, gdy są napotkani na nAChR przez pewien czas (sekundy lub minuty, w zależności od stężenia i podtypu nAChR), przewlekła ekspozycja na agonistę może również prowadzić do długotrwałej dezaktywacji funkcjonalnej z powodu szybkiej i uporczywej odczulania. Badano częściowych agonistów nAChR, ponieważ wydają się oni być pomocni w rzucaniu palenia. Uważa się, że częściowi agoniści wiążą się z nAChR i stymulują uwalnianie dopaminy w mniejszych porcjach niż agoniści, a zatem kompensują brak nikotyny.
Brak specyficzności wśród niektórych agonistów nikotynowych jest dobrze znany i stanowi potencjalny problem podczas stosowania ich do leczenia chorób wymagających działania na określony podtyp nAChR. Wśród tych niespecyficznych agonistów są na przykład ACh, nikotyna i epibatydyna, które wszystkie celują w więcej niż jeden podtyp nAChR.
Pharmacophore
Rozwój farmakoforu agonisty nAChR rozpoczął się w 1970 roku, kiedy zaproponowano, że wiązanie agonistów z receptorem zależy od dodatnio naładowanego atomu azotu i wiązania wodorowego tworzącego się z karbonylowego atomu tlenu w acetylocholinie lub atomu azotu w (S) - nikotyna. Od tego czasu wykazano, że centrum kationowe, atomy, które są elektroujemne i mogą tworzyć wiązania wodorowe wraz ze środkiem pierścienia pirydynowego w (S) -nikotynie, są korzystne. Stereochemia jest częścią farmakoforu, co wyraźnie widać w przypadku (S) - i (R) - nikotyny, gdzie (S) - enancjomer jest 10-100 razy silniejszy. Pierścień azabicykliczny epibatydyny jest kolejnym przykładem korzystnych oddziaływań sterycznych na receptory. Sugerowano, że specyficzna odległość między azotem, N + -N, jest ważna dla powinowactwa agonisty, ale pojawiła się debata na temat jej wpływu. Nowsza teoria głosi, że odległość 7-8 Å między punktami, które dopełniają protonowany atom azotu i akceptor wiązania wodorowego, zwiększy siłę działania. Niska gęstość elektronowa blisko protonowanego azotu i wyższa gęstość elektronów blisko pierścienia pirydynowego jest faworyzowana w protonowanych ligandach nikotynowych zawierających pierścień pirydynowy. W późniejszych latach naukowcy zaczęli bardziej interesować się receptorami podtypu α7 i α4β2 w opracowywaniu leków do leczenia uzależnienia od nikotyny i zaburzeń poznawczych, takich jak choroba Alzheimera.
Relacje struktura-aktywność
Zależności struktura-aktywność: agoniści mięśni nAChR
Przeprowadzono różne modele, w których badano powinowactwo agonistów nAChR do podtypu receptora, aby pomóc zidentyfikować cząsteczki, grupy i konformację przestrzenną, które są niezbędne do uzyskania większego powinowactwa. Przy użyciu modelu receptora mięśniowego nAChR podtypu (α1) 2 β1δγ uzyskano następujące wyniki:
- anatoksyna > epibatydyna > acetylocholina > DMPP >> cytyzyna > pyrantel > nikotyna > konina > tubocurare > lobelina ,
gdzie anatoksyna ma najwyższą skuteczność, a tubocur są najniższą. Z drugiej strony acetylocholina indukowała znacznie dłuższy czas otwarcia receptora, chociaż anatoksyna jest silniejsza. Wyniki sugerują, że pochodne anatoksyny byłyby pomocne w zrozumieniu zależności struktura-aktywność (SAR) dla nAChR mięśni.
Chlorek sukcynylocholiny , który jest już na rynku lekiem, jest estrem bischoliny i krótko działającym środkiem zwiotczającym mięśnie. Estry bischoliny są związkami, które mogą działać jako konkurencyjny agonista wobec nAChR typu mięśniowego i zostały użyte w badaniach SAR. W modelu Torpedo (α1) 2 β1δγ nAChR wykazano, że siła działania agonistów estru bischolinowego zależy od długości łańcucha, gdy siła wzrasta wraz z dłuższymi łańcuchami. Wydaje się, że skuteczność jest niezależna od długości łańcucha, ponieważ najwyższą skuteczność obserwuje się w przypadku estrów bischoliny z 4-7 CH
2 jednostek i jest niższa zarówno dla mniejszej liczby CH
2 jednostki i więcej.
Zależności struktura-aktywność: agoniści α4β2 nAChR
Połączenie elementów strukturalnych ACh i nikotyny, a także zmniejszenie elastyczności konformacyjnej przez zastosowanie pierścienia cyklopropanu doprowadziło do odkrycia silnych i selektywnych ligandów α4β2 nAChR. Modulację trzech elementów strukturalnych, łącznika, podstawienia na grupie aminowej i pierścienia pirydynowego można wykorzystać do określenia wpływu na siłę i selektywność ligandów. Czynniki zmniejszające wiązanie to zawada przestrzenna na grupie aminowej i łączniki, które są nasyconymi / nienasyconymi łańcuchami węglowymi. Korzystne są krótkołańcuchowe łączniki eterowe. Korzystny wpływ na wiązanie obserwuje się w przypadku podstawienia na pierścieniu pirydynowym zarówno mono-, jak i dipodstawienia halogenami wśród innych grup. Podstawienie grupy aminowej trzema różnymi amidami zwiększyło powinowactwo wiązania, w którym metyloamid miał najwyższe wiązanie. Niższe wiązanie w innych podstawionych amidach wyjaśniono zawadą przestrzenną lub brakiem grupy metylowej, co prowadzi do utraty interakcji hydrofobowej. Stereochemia azotu pirydynowego i / lub pierścienia pirydynowego i jego efekty stereoelektroniczne mają subtelny korzystny wpływ na wiązanie z α4β2 nAChR. W ten sposób wykazano, że ligand eteru pirydylowego z podstawieniem bromowym na pirydynie i metyloetyloamidem na grupie aminowej miał największą siłę.
Zależności struktura-aktywność: agoniści α7 nAChR
Poszukiwanie selektywnych i silnych agonistów α7 nAChR doprowadziło do powstania szeregu związków, które mają duży potencjał jako kandydaci na leki. Jedno z takich poszukiwań dało SEN12333 / WAY-317538 wśród innych związków, które mają pożądane profile farmakokinetyczne i są selektywne względem α7 nAChR w porównaniu z α1, α3 i α4β2 nAChR. Zaproponowano zależności między strukturą i aktywnością tych związków. Optymalny farmakofor agonisty α7 nAChR składa się z trzech części. Istnieje podstawowa reszta połączona z łańcuchem węglowym połączona z resztą aromatyczną mostkiem amidowym. Mostek amidowy można odwrócić bez wpływu na siłę działania agonisty. Grupa bi- arylowa wykazuje większą siłę działania niż grupa monoarylowa, ponieważ ugrupowanie aromatyczne i podstawienie w pozycji 2 późniejszej grupy arylowej dodatkowo zwiększy siłę. Siła jest wyższa w przypadku agonistów z dawcą / akceptorem H + w późniejszej grupie arylowej w grupie biarylowej. Duża liczba akceptorów wiązań wodorowych może zmniejszać przepuszczalność przez barierę krew-mózg (BBB) ze względu na polarną powierzchnię i należy to wziąć pod uwagę przy projektowaniu agonistów ukierunkowanych na α7 nAChR.
Różne cykliczne grupy aminowe mogą działać jako ugrupowanie podstawowe, a siła pozostaje względnie niezmieniona, na przykład arylopiperazyna , piperydyna i morfolina . Acykliczna trzeciorzędowa amina jest tolerowana jako reszta podstawowa, ale większe grupy steryczne są mniej tolerowane.
Wiadomo, że wiele pochodnych chinuklidyny, takich jak amid chinuklidyny, jest agonistami α7 nAChR. Badania SAR dla amidu chinuklidyny pozwoliły zidentyfikować czynniki wpływające na siłę i powinowactwo tych agonistów. Preferowana jest para-podstawienie w pierścieniu chinuklidynowym i konfiguracja 3- (R) w stereochemii. Zwiększoną aktywność obserwuje się, gdy 5-członowy pierścień jest skondensowany z resztą aromatyczną. Dalsze wzmocnienie jest widoczne, gdy skondensowany pierścień jest w stanie dostarczyć rezonans elektronowy karbonylowi amidu, podczas gdy aktywność zmniejszy się, gdy skondensowany pierścień zawiera atom dostarczający wiązanie wodorowe. Przypuszcza się, że sztywność chinuklidyny i ortogonalna orientacja mostka azotowego w stosunku do amidowej grupy karbonylowej jest ważna dla optymalnego wiązania. Stabilność niektórych silniejszych pochodnych amidu chinuklidyny w modelach szczurów in vitro była niska, jednak po dodaniu grupy metylowej w pozycji 2 pierścienia chinuklidyny stabilność znacznie wzrosła.
Rozwój leków
Rozwój nikotynowych agonistów receptora acetylocholiny rozpoczął się we wczesnych latach 90-tych po odkryciu pozytywnego wpływu nikotyny na pamięć zwierząt. Od tamtego czasu rozwój agonistów nikotynowych receptorów acetylocholiny przeszedł długą drogę. Agoniści nikotynowego receptora acetylocholiny zyskują coraz większe zainteresowanie jako kandydaci na leki na liczne zaburzenia ośrodkowego układu nerwowego, takie jak choroba Alzheimera , schizofrenia , zespół nadpobudliwości psychoruchowej z deficytem uwagi (ADHD) i uzależnienie od nikotyny . Receptory nikotynowe acetylocholiny to receptory występujące w ośrodkowym układzie nerwowym , obwodowym układzie nerwowym i mięśniach szkieletowych. Są to kanały jonowe bramkowane ligandami z miejscami wiązania dla acetylocholiny, a także innych agonistów . Kiedy agoniści wiążą się z receptorem , stabilizuje stan otwarty kanału jonowego, umożliwiając napływ kationów .
W 2009 roku na rynku było co najmniej pięć leków wpływających na nikotynowe receptory acetylocholiny.
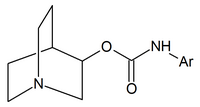
|

|
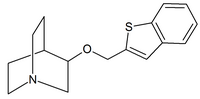
|
| Karbaminiany chinuklidyny | Amidy chinuklidyny | Etery chinuklidynowe |
Produkty agonisty nikotynowego
| Składnik czynny | Nazwa produktu | Nazwa chemiczna | Postać farmaceutyczna | Właściwości farmakodynamiczne | Zastosowanie terapeutyczne | Struktura |
|---|---|---|---|---|---|---|
| Winian warenikliny | Champix, Chantix | 7,8,9,10-tetrahydro-6,10-metano-6H-pirazyno [2,3-h] [3] benzazepina | Tabletka powlekana | Częściowy agonista nikotynowego receptora acetylocholiny, podtyp α 4 β 2 | Leczenie uzależnienia od tytoniu |

|
| Bromowodorek galantaminy | Reminyl, Nivalin, Razadyne i Razadyn ER | 4a, 5,9,10,11,12-heksahydro-3-metoksy-11-metylo-6H-benzofuro [3a, 3,2-ef] [2] -benzazepin-6-ol | Kapsułka o przedłużonym uwalnianiu, tabletka powlekana, roztwór doustny | Inhibitor cholinoesterazy i niekonkurencyjny agonista nikotynowego receptora acetylocholiny | Leczenie otępienia wywołanego chorobą Alzheimera |
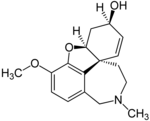
|
| Nikotyna | Nicorette , Nicotinell, Niquitin, Buty NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3 - [(2S) -1-metylopirolidyn-2-ylo] pirydyna | Plaster transdermalny, guma, inhalator, aerozol do nosa, pastylka do ssania, mikrotab i naturalnie występuje w tytoniu | Agonista receptora nikotynowego, zarówno typu Ganglion , jak i α 4 β 2 | Leczenie uzależnienia od tytoniu |
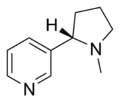
|
| Carbachol | Miostat | 2 - [(aminokarbonylo) oksy] -N, N, N-trimetyloetanoaminium | Roztwór wewnątrzgałkowy | Agonista cholinergiczny | Leczenie jaskry |
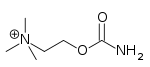
|
| Chlorek suksametonium (chlorek sukcynylocholiny) | Anektyna, chlorek quelicyny suksametonium | 2,2 '- [(1,4-dioksobutano-1,4-diylo) bis (oksy)] bis (N, N, N-trimetyloetanoaminium) | Wstrzyknięcie dożylne lub domięśniowe | Depolaryzujący środek blokujący przewodnictwo nerwowo-mięśniowe | Krótko działający środek zwiotczający mięśnie |
|
| Epibatydyna | Nie wymienione | 2- (6-chloropirydyn-3-ylo) -7-azabicyklo [2.2.1] heptan | Nie wymienione | Agonista nikotynowego receptora acetylocholiny | Nie używany jako lek |
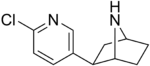
|
Do innych agonistów nikotynowych, choć ogólnie o ograniczonym zastosowaniu klinicznym, należą:
- lobelina , agonista receptorów nikotynowych typu Ganglion, a także wpływa na zakończenia nerwów czuciowych
- epibatydyna agonista w rodzaju zwoju , α4β2 i a7 receptora
- decamethonium powoduje bloku depolaryzację w mięśniowych receptorów, podobnie suksametonium
Aktywność nikotynowa a aktywność muskarynowa
| Porównanie agonistów cholinergicznych | ||||
|---|---|---|---|---|
| Substancja | Specyfika receptora | Hydroliza przez acetylocholinoesterazę |
Komentarze | |
| Muskarynowy | Nikotynowy | |||
| Cholina | +++ | +++ | ++ | Niezbędny składnik odżywczy |
| Acetylocholina | +++ | +++ | +++ | Endogenny ligand |
| Carbachol | ++ | +++ | - | Stosowany w leczeniu jaskry |
| Metacholina | +++ | + | ++ | |
| Bethanechol | +++ | - | - | Stosowany przy hipotonii pęcherza i przewodu pokarmowego. |
| Muskaryna | +++ | - | - | Naturalny alkaloid występujący w niektórych grzybach. Przyczyna zatrucia grzybami |
| Nikotyna | - | +++ | - | Naturalny alkaloid występujący w roślinie tytoniu . |
| Pilokarpina | ++ | - | - | Używany w jaskrze |
| Oksotremoryna | ++ | - | - | |
Aktualny stan
Obecnie badania nad agonistami receptorów nikotynowych i projektowanie leków mają na celu leczenie wielu chorób i zaburzeń OUN.
Targacept ma trzech kandydatów na leki, które są w trakcie badań klinicznych ; AZD3480 (TC-1734) dla ADHD, który jest obecnie w fazie II badań klinicznych, AZD1446 (TC-6683) dla choroby Alzheimera we współpracy z AstraZeneca i TC-5619 dla zaburzeń poznawczych w schizofrenii.
Memory Pharmaceuticals ze swoim partnerem Roche ma jednego kandydata na lek, MEM 3454 (RG3487), częściowego agonistę receptora nikotynowego α7 , stosowanego w chorobie Alzheimera.
Abbott Laboratories we współpracy z NeuroSearch ma dwóch kandydatów na leki w badaniach klinicznych: ABT-894 , selektywnego agonistę receptora nikotynowego α4β2, dla ADHD i ABT-560 , neuronalny modulator receptora nikotynowego, który został wybrany przez firmę Abbott w 2006 roku jako nowy kandydat do opracowania. na dysfunkcje poznawcze.
Farmaceutyki EnVivo mają jednego kandydata na lek w badaniach klinicznych, EVP-6124, selektywnego agonistę receptora nikotynowego α7 stosowanego w chorobie Alzheimera i schizofrenii oraz jeden związek uzupełniający, EVP-4473, który pomyślnie zakończył prace przedkliniczne .
Zobacz też
- Muskarynowy receptor acetylocholiny
- Agonista muskarynowy
- Antagonista muskarynowy
- Receptor nikotynowy acetylocholiny
- Antagonista nikotynowy
- Lek parasympatykomimetyczny
Bibliografia
Zewnętrzne linki
![]() Media związane z agonistami nikotynowymi w Wikimedia Commons
Media związane z agonistami nikotynowymi w Wikimedia Commons
- nikotynowe + agoniści w US National Library of Medicine Medical Subject Headings (MeSH)
- Lista agentów MeSH 82018722






