Trypanosomatoza afrykańska - African trypanosomiasis
| Trypanosomatoza afrykańska | |
|---|---|
| Inne nazwy | Śpiączka, śpiączka afrykańska |
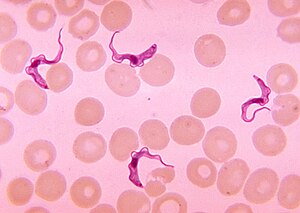 | |
| Trypanosoma tworzy się w rozmazie krwi | |
| Specjalność | Choroba zakaźna |
| Objawy |
Etap 1 : Gorączka, bóle głowy, swędzenie, bóle stawów Etap 2 : Problemy ze snem , dezorientacja , słaba koordynacja |
| Zwykły początek | 1-3 tygodnie po ekspozycji |
| Rodzaje | Trypanosoma brucei gambiense (TbG), Trypanosoma brucei rhodesiense (TbR) |
| Powoduje | Trypanosoma brucei roznoszona przez muchy tse-tse |
| Metoda diagnostyczna | Rozmaz krwi , nakłucie lędźwiowe |
| Lek | Feksinidazol , pentamidyna , suramina , eflornityna , nifurtimoks |
| Rokowanie | Śmiertelny bez leczenia |
| Częstotliwość | 977 (2018) |
| Zgony | 3500 (2015) |
Trypanosomatoza afrykańska , znana również jako śpiączka afrykańska lub po prostu śpiączka afrykańska , jest przenoszoną przez owady infekcją pasożytniczą ludzi i innych zwierząt. Jest to spowodowane przez gatunek Trypanosoma brucei . Ludzie są zarażeni dwoma typami, Trypanosoma brucei gambiense (TbG) i Trypanosoma brucei rhodesiense (TbR). TbG powoduje ponad 98% zgłoszonych przypadków. Oba są zwykle przenoszone przez ukąszenie zarażonej muchy tse-tse i są najczęściej spotykane na obszarach wiejskich.
Początkowo pierwszy etap choroby charakteryzuje się gorączką, bólami głowy, swędzeniem i bólami stawów, rozpoczynającymi się od jednego do trzech tygodni po ukąszeniu. Kilka tygodni lub miesięcy później, drugi etap zaczyna się od dezorientacji, słabej koordynacji, drętwienia i problemów ze snem. Diagnoza polega na znalezieniu pasożyta w rozmazie krwi lub w płynie węzła chłonnego. Nakłucie lędźwiowe są często potrzebne, aby odróżnić pierwszego i drugiego stadium choroby.
Zapobieganie ciężkim chorobom obejmuje badania przesiewowe populacji zagrożonej za pomocą badań krwi pod kątem TbG. Leczenie jest łatwiejsze, gdy choroba zostanie wykryta wcześnie i przed wystąpieniem objawów neurologicznych. Leczenie pierwszego etapu odbywało się za pomocą leków pentamidyny lub suraminy . Leczenie drugiego etapu obejmowało eflornitynę lub połączenie nifurtimoxu i eflornityny na TbG. Fexinidazole jest nowsza leczenie, które może być przyjmowany doustnie, zarówno dla etapów TBG. Podczas gdy melarsoprol działa na oba typy, zazwyczaj stosuje się go tylko w przypadku TbR, ze względu na poważne skutki uboczne. Bez leczenia śpiączka zazwyczaj kończy się śmiercią.
Choroba występuje regularnie w niektórych regionach Afryki Subsaharyjskiej, a zagrożona populacja wynosi około 70 milionów w 36 krajach. Szacuje się, że 11 000 osób jest obecnie zarażonych 2800 nowymi infekcjami w 2015 roku. W 2018 roku odnotowano 977 nowych przypadków. W 2015 r. spowodowała około 3500 zgonów, w porównaniu z 34 000 w 1990 r. Ponad 80% tych przypadków dotyczy Demokratycznej Republiki Konga . W najnowszej historii miały miejsce trzy główne epidemie: jedno w latach 1896-1906, głównie w Ugandzie i dorzeczu Konga, oraz dwa w latach 1920 i 1970 w kilku krajach afrykańskich. Jest klasyfikowana jako zaniedbana choroba tropikalna . Inne zwierzęta, takie jak krowy, mogą przenosić chorobę i zarazić się, w takim przypadku jest to znane jako Nagana lub trypanosomatoza zwierzęca .
Symptomy i objawy
Objawy trypanosomatozy afrykańskiej występują w dwóch stadiach: hemolimfatycznym i neurologicznym (charakteryzującym się inwazją pasożytniczą ośrodkowego układu nerwowego). Objawy neurologiczne występują jednak oprócz początkowych cech, a te dwa etapy mogą być trudne do rozróżnienia na podstawie samych cech klinicznych.
Zgłaszano, że choroba objawia się nietypowymi objawami u osób zakażonych, które pochodzą z obszarów nieendemicznych (np. podróżnych). Przyczyny tego są niejasne i mogą być genetyczne. Niewielka liczba takich przypadków może również prowadzić do wypaczenia ustaleń. U takich osób zakażenie objawia się głównie gorączką z objawami żołądkowo-jelitowymi (np. biegunką i żółtaczką), a limpadenopatia rozwija się rzadko.
Trypanosomalny chancre
Choroba ogólnoustrojowa jest czasami zapowiadana przez wrzód trypanosomalny rozwijający się w miejscu ukąszenia zakaźnej muchy w ciągu 2 dni od zakażenia. Chancre najczęściej obserwuje się w T. b. zakażenie rhodesiense i tylko rzadko w T.b. gambiense (jednak w zakażeniu T. b. gambiense owrzodzenia występują częściej u osób z obszarów nieendemicznych).
Faza hemolimfatyczna
Okres inkubacji dla T.b. wynosi 1–3 tygodnie . rhodesiense i dłuższe (ale mniej dokładnie scharakteryzowane) w T. b. infekcja gambiense . Pierwszy/początkowy etap, zwany fazą hemolimfatyczną, charakteryzuje się nieswoistymi, uogólnionymi objawami, takimi jak: gorączka (przerywana) , bóle głowy (silne), bóle stawów , swędzenie , osłabienie, złe samopoczucie, zmęczenie, utrata masy ciała, powiększenie węzłów chłonnych i hepatosplenomegalia.
Diagnoza może być opóźniona z powodu niejasności początkowych objawów. Choroba może być również mylona z malarią (która w rzeczywistości może występować jako koinfekcja).
Przerywana gorączka
Gorączka jest przerywana, a ataki trwają od dnia do tygodnia, oddzielone odstępami od kilku dni do miesiąca lub dłużej. W przebiegu choroby epizody gorączki stają się rzadsze.
Limfadenopatia
Inwazja układu krwionośnego i limfatycznego przez pasożyta wiąże się z silnym obrzękiem węzłów chłonnych , często do ogromnych rozmiarów. Najczęściej zajęte są tylne węzły chłonne szyjne, ale może również wystąpić zajęcie węzłów chłonnych pachowych, pachwinowych i nabłonkowych. Może pojawić się znak Winterbottoma , charakterystyczne powiększone węzły chłonne wzdłuż karku. Znak Winterbottoma jest powszechny w T.b. infekcja gambiense .
Inne funkcje
U dotkniętych chorobą mogą dodatkowo wystąpić: wysypka skórna, niedokrwistość hemolityczna, powiększenie wątroby i nieprawidłowa czynność wątroby, powiększenie śledziony, zaburzenia endokrynologiczne, zajęcie serca (np. zapalenie osierdzia i zastoinowa niewydolność serca) oraz zajęcie oczu.
Liczne plamy krwawienia do skóry nogi u osoby zakażonej T.b. rhodesiense
Faza neurologiczna
Druga faza choroby, faza neurologiczna (zwana również fazą oponowo - mózgową ), rozpoczyna się, gdy pasożyt atakuje ośrodkowy układ nerwowy, przechodząc przez barierę krew-mózg . Progresji do fazy neurologicznych występuje po szacunkowo 21-60 dni w przypadku T. b. rhodesiens e, a 300–500 dni w przypadku T.b. infekcja gambiense .
W rzeczywistości te dwie fazy nakładają się na siebie i są trudne do rozróżnienia na podstawie samych cech klinicznych; ustalenie rzeczywistego stadium choroby uzyskuje się poprzez badanie płynu mózgowo-rdzeniowego na obecność pasożyta.
Zaburzenia snu
Zaburzenia snu i czuwania są wiodącą cechą stadium neurologicznego i nadały chorobie swoją potoczną nazwę śpiączka afrykańska . Zainfekowane osoby doświadczają zdezorganizowanego i fragmentarycznego cyklu snu i czuwania. Osoby dotknięte chorobą doświadczają inwersji snu, co powoduje sen i senność w ciągu dnia oraz nocne okresy czuwania i bezsenności. Dodatkowo osoby dotknięte chorobą doświadczają również epizodów nagłej senności.
Objawy neurologiczne/neuropoznawcze
Objawy neurologiczne obejmują: drżenie , ogólne osłabienie mięśni, niedowład połowiczy , porażenie kończyn, nieprawidłowe napięcie mięśni, zaburzenia chodu, ataksję, zaburzenia mowy, parestezje, przeczulicę, znieczulenie, zaburzenia widzenia, zaburzenia odruchów, drgawki i śpiączkę. Ruchy podobne do Parkinsona mogą powstać z powodu niespecyficznych zaburzeń ruchowych i zaburzeń mowy.
Objawy psychiatryczne/behawioralne
Osoby mogą wykazywać objawy psychiatryczne, które czasami mogą zdominować diagnozę kliniczną i mogą obejmować agresywność, apatię , drażliwość, reakcje psychotyczne i halucynacje , niepokój , labilność emocjonalną , splątanie , manię , deficyt uwagi i majaczenie .
Zaawansowana/późna choroba i jej skutki
Bez leczenia choroba jest zawsze śmiertelna, z postępującym pogorszeniem stanu psychicznego prowadzącym do śpiączki, ogólnoustrojowej niewydolności narządów i śmierci. Nieleczona infekcja T.b. rhodesiense spowoduje śmierć w ciągu kilku miesięcy, podczas gdy nieleczona infekcja T.b. gambiense spowoduje śmierć po kilku latach. Uszkodzenia powstałe w fazie neurologicznej są nieodwracalne.
Przyczyna
Trypanosoma brucei gambiense odpowiada za większość przypadków afrykańskiej trypanosomatozy, a jej głównym rezerwuarem są ludzie, podczas gdy Trypanosoma brucei rhodesiense jest głównie odzwierzęca, ze sporadycznymi zakażeniami u ludzi. Trypanosomatoza afrykańska jest zależna od interakcji pasożyta (trypanosom) z muchami tsetse (wektor), jak również z żywicielem (człowiekiem Trypanosoma brucei gambiense i zwierzętami Trypanosoma brucei rhodesiense ). Ryzyko zarażenia trypanosomatozą afrykańską zależy od kontaktu z zarażoną muchą tse-tse.
Trypanosoma brucei
Istnieją dwa podgatunki pasożyta odpowiedzialne za wywołanie choroby u ludzi. Trypanosoma brucei gambiense powoduje choroby w zachodniej i środkowej Afryce , natomiast Trypanosoma brucei rhodesiense ma ograniczony zasięg geograficzny i jest odpowiedzialna za wywoływanie choroby w Afryce wschodniej i południowej. Ponadto trzeci podgatunek pasożyta znany jako Trypanosoma brucei brucei jest odpowiedzialny za atakowanie zwierząt, ale nie ludzi.
Ludzie są głównym rezerwuarem T.b. gambiense, ale ten gatunek można również znaleźć u świń i innych zwierząt. Dzikie zwierzęta łowne i bydło są głównym rezerwuarem T.b. Rodezjana . Pasożyty te infekują przede wszystkim osobniki w Afryce subsaharyjskiej, ponieważ tam znajduje się wektor (mucha tse-tse). Dwie ludzkie postacie choroby również różnią się znacznie intensywnością. T.b. gambiense powoduje stan przewlekły, który może pozostawać w fazie biernej przez miesiące lub lata, zanim pojawią się objawy, a infekcja może trwać około trzech lat, zanim nastąpi śmierć.
T.b. rhodesiense jest ostrą postacią choroby, a śmierć może nastąpić w ciągu kilku miesięcy od pojawienia się objawów w ciągu kilku tygodni i jest bardziej zjadliwa i szybciej się rozwija niż T.b. gambiense . Ponadto trypanosomy są otoczone płaszczem złożonym z różnych glikoprotein powierzchniowych (VSG). Białka te działają w celu ochrony pasożyta przed wszelkimi czynnikami litycznymi obecnymi w ludzkim osoczu. Układ odpornościowy gospodarza rozpoznaje glikoproteiny obecne na płaszczu pasożyta, co prowadzi do wytwarzania różnych przeciwciał (IgM i IgG).
Te przeciwciała będą następnie działać, aby zniszczyć pasożyty krążące we krwi. Jednak spośród kilku pasożytów obecnych w plazmie, niewielka liczba z nich doświadczy zmian w ich powłokach powierzchniowych, co spowoduje powstanie nowych VSG. Zatem przeciwciała wytwarzane przez układ odpornościowy nie będą już rozpoznawać pasożyta prowadzącego do proliferacji, dopóki nie zostaną stworzone nowe przeciwciała do zwalczania nowych VSG. W końcu układ odpornościowy nie będzie już w stanie zwalczyć pasożyta z powodu ciągłych zmian w VSG i pojawi się infekcja.
Wektor
| Rodzaj | Trypanosoma | Dystrybucja | V ector |
|---|---|---|---|
| Chroniczny | T. brucei gambiense | Afryka Zachodnia |
G. palpalis
G. tachinoides G. morsitans |
| Ostry | T. brucei rhodesiense | Afryka Wschodnia |
G. morsitans
G. swynnertoni G. pallidipes G. fuscipes |
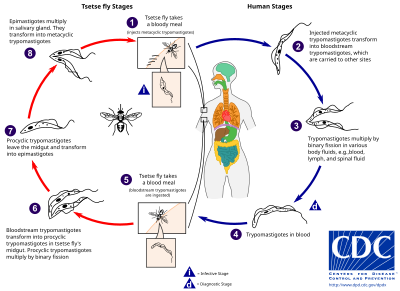
Tsetse muchy (rodzaj Glossina ) jest duża, brązowy, gryzienie muchy, która służy zarówno jako gospodarza i wektora do świdrowiec pasożytów. Pobierając krew od ssaka, zarażona mucha tse-tse wstrzykuje metacykliczne trypomastigoty do tkanki skórnej. Od ugryzienia pasożyty najpierw dostają się do układu limfatycznego, a następnie do krwioobiegu. Wewnątrz żywiciela ssaka przekształcają się w trypomastigoty krwioobiegu i są przenoszone do innych miejsc w ciele, docierają do innych płynów ustrojowych (np. limfy, płynu mózgowo-rdzeniowego) i kontynuują replikację przez rozszczepienie binarne .
Cały cykl życiowy afrykańskich trypanosomów jest reprezentowany przez etapy zewnątrzkomórkowe. Mucha tse-tse zostaje zarażona trypomastigotami krwionośnymi podczas spożywania mączki z krwi zarażonego żywiciela ssaka. W jelicie środkowym muchy pasożyty przekształcają się w procykliczne trypomastigoty, mnożą się przez rozszczepienie binarne, opuszczają jelito środkowe i przekształcają się w epimastigoty. Epimastigotes docierają do gruczołów ślinowych muszki i kontynuują namnażanie przez podział binarny.
Cały cykl życia muchy trwa około trzech tygodni. Oprócz ukąszenia muchy tse - tse choroba może być przenoszona przez:
- Zakażenie matki z dzieckiem: trypanosom może czasami przenikać przez łożysko i infekować płód.
- Laboratoria: przypadkowe infekcje, na przykład poprzez obchodzenie się z krwią osoby zakażonej i przeszczepianie narządów, chociaż zdarza się to rzadko.
- Transfuzja krwi
- Kontakt seksualny (może to być możliwe)
Muchy końskie ( Tabanidae ) i stajenne ( Muscidae ) prawdopodobnie odgrywają rolę w przenoszeniu nagana (zwierzęcej postaci śpiączki) i ludzkiej postaci choroby.
Patofizjologia
Tryptophol jest związkiem chemicznym wytwarzanym przez pasożyta trypanosomalnego w śpiączce, który indukuje sen u ludzi.
Diagnoza

Złotym standardem diagnozy jest identyfikacja trypanosomów w próbce za pomocą badania mikroskopowego. Próbki, które można wykorzystać do diagnozy, obejmują płyn chancre , aspiraty węzłów chłonnych, krew, szpik kostny oraz, na etapie neurologicznym, płyn mózgowo-rdzeniowy . Wykrywanie przeciwciał swoistych dla trypanosomu może być wykorzystane do diagnozy, ale czułość i specyficzność tych metod są zbyt zmienne, aby można je było stosować samodzielnie do diagnozy klinicznej. Co więcej, serokonwersja występuje po wystąpieniu objawów klinicznych podczas T.b. zakażenie rhodesiense , więc ma ograniczone zastosowanie diagnostyczne.
Trypanosomy można wykryć z próbek przy użyciu dwóch różnych preparatów. Do poszukiwania ruchliwych trypanosomów można użyć mokrego preparatu. Alternatywnie utrwalony (wysuszony) rozmaz można wybarwić techniką Giemsy lub Fielda i zbadać pod mikroskopem. Często pasożyty są w stosunkowo niewielkiej ilości w próbce, więc techniki koncentracji pasożytów mogą być stosowane przed badaniem mikroskopowym. W przypadku próbek krwi obejmują one wirowanie, a następnie badanie kożuszka leukocytarno- płytkowego ; mini-wymiana anionowa/wirowanie; oraz technika ilościowego kożuszka leukocytarnego (QBC). W przypadku innych próbek, takich jak płyn mózgowo-rdzeniowy, techniki zagęszczania obejmują wirowanie, a następnie badanie osadu.
Dostępne są również trzy testy serologiczne do wykrywania pasożyta: mikro-CATT (test aglutynacji kart na trypanosomatozę), wb-CATT i wb-LATEX. Pierwsza wykorzystuje suszoną krew, a pozostałe dwie próbki krwi pełnej. Badanie z 2002 r. wykazało, że wb-CATT jest najbardziej skuteczny w diagnostyce, podczas gdy wb-LATEX jest lepszym badaniem w sytuacjach, w których wymagana jest większa czułość.
Zapobieganie
Obecnie istnieje niewiele medycznie powiązanych opcji zapobiegania trypanosomatozie afrykańskiej (tj. nie istnieje żadna szczepionka na odporność). Chociaż ryzyko infekcji spowodowanej ukąszeniem przez muchę tse-tse jest niewielkie (szacowane na mniej niż 0,1%), stosowanie środków odstraszających owady, noszenie odzieży z długimi rękawami, unikanie obszarów gęstych tse-tse, wdrażanie metod usuwania krzaków i ubój zwierzyny są najlepsze. opcje pozwalające uniknąć infekcji dostępne dla lokalnych mieszkańców dotkniętych obszarów.
W lipcu 2000 r. podjęto uchwałę w sprawie utworzenia Panafrykańskiej Kampanii Eradykacji Tsetse i Trypanosomatozy (PATTEC). Kampania ma na celu wyeliminowanie poziomów populacji wektorów tsetse, a następnie choroby pierwotniaków, poprzez zastosowanie celów impregnowanych insektycydami, pułapek na muchy, bydła traktowanego insektycydami, rozpylania ultraniskiej dawki powietrza/gruntu (SAT) miejsc spoczynku tse-tse i sterylnych technika owadów (SIT). Zastosowanie SIT na Zanzibarze okazało się skuteczne w eliminowaniu całej populacji much tse-tse, ale było kosztowne i stosunkowo niepraktyczne w wielu krajach endemicznych dotkniętych trypanosomatozą afrykańską.
Program pilotażowy w Senegalu zmniejszył populację much tse-tse aż o 99%, wprowadzając samce muszek, które zostały wysterylizowane przez ekspozycję na promienie gamma .
Regularny aktywny nadzór, obejmujący wykrywanie i natychmiastowe leczenie nowych infekcji, oraz kontrola much tse-tse jest podstawą strategii stosowanej do kontrolowania śpiączki. Najlepszym podejściem jest systematyczne badanie społeczności zagrożonych, ponieważ badania przesiewowe poszczególnych przypadków nie są praktyczne w regionach endemicznych. Systematyczne badania przesiewowe mogą mieć formę mobilnych klinik lub stacjonarnych ośrodków badań przesiewowych, w których zespoły codziennie podróżują do obszarów o wysokim wskaźniku infekcji. Takie badania przesiewowe są ważne, ponieważ wczesne objawy nie są wystarczająco wyraźne lub poważne, aby osoby z chorobą gambiense musiały zwrócić się o pomoc medyczną, szczególnie w bardzo odległych rejonach. Również diagnoza choroby jest trudna, a pracownicy służby zdrowia mogą nie kojarzyć tak ogólnych objawów z trypanosomatozą. Systematyczne badania przesiewowe umożliwiają wykrycie i leczenie choroby we wczesnym stadium przed jej postępem oraz usunięcie potencjalnego rezerwuaru dla człowieka. Zgłoszono pojedynczy przypadek transmisji śpiączki z Afryki Zachodniej drogą płciową.
Leczenie
Pierwszy etap
Leczenie choroby pierwszym etapie jest fexinidazole doustnie lub pentamidyny poprzez wstrzyknięcie T. b. gambiense . Suraminę we wstrzyknięciu stosuje się w T.b. Rodezjana .
Drugi etap
Feksinidazol może być stosowany w drugim stadium TbG, jeśli choroba nie jest ciężka. W przeciwnym razie bardziej skuteczny wydaje się schemat obejmujący kombinację nifurtimoxu i eflornityny , leczenie skojarzone nifurtimox-eflornithine (NECT) lub samą eflornitynę, co skutkuje mniejszą liczbą działań niepożądanych. Te zabiegi mogą zastąpić melarsoprol, jeśli są dostępne. NECT ma tę zaletę, że wymaga mniej zastrzyków eflornityny.
Dożylny melarsoprol był wcześniej standardowym leczeniem w drugim stadium choroby (faza neurologiczna) i jest skuteczny w obu typach. Melarsoprol jest jedynie do drugiego etapu obróbki T. b. rodezja ; jednak powoduje śmierć u 5% osób, które ją przyjmują. Może wystąpić oporność na melarsoprol.
Rokowanie
Nieleczona, T.b. gambiense prawie zawsze kończy się śmiercią, przy czym tylko kilka osób w długoterminowym 15-letnim okresie obserwacji przeżyło po odmowie leczenia. T.b. rhodesiense , będący bardziej ostrą i ciężką postacią choroby, jest konsekwentnie śmiertelny, jeśli nie jest leczony. Progresja choroby jest bardzo zróżnicowana w zależności od postaci choroby. Dla osób zarażonych T.b. gambiense , który stanowi 98% wszystkich zgłoszonych przypadków, osoba może być zarażona przez miesiące, a nawet lata bez oznak ani objawów, aż do zaawansowanego stadium choroby, kiedy jest już za późno na skuteczne leczenie. Dla osób dotkniętych T.b. rhodesiense , który stanowi 2% wszystkich zgłoszonych przypadków, objawy pojawiają się w ciągu kilku tygodni lub miesięcy od zakażenia. Postęp choroby jest szybki i atakuje centralny układ nerwowy, powodując śmierć w krótkim czasie.
Epidemiologia

W 2010 r. spowodowała około 9 000 zgonów, w porównaniu z 34 000 w 1990 r. W 2000 r. liczba lat życia skorygowanych o niepełnosprawność (od 9 do 10 lat) utraconych z powodu śpiączki wyniosła 2,0 mln. W latach 2010-2014 było szacunkowo 55 milionów osób zagrożonych trypanosomatozą afrykańską gambiense i ponad 6 milionów osób zagrożonych trypanosomatozą rhodesiense . W 2014 roku Światowa Organizacja Zdrowia zgłosiła 3797 przypadków ludzkiej trypanosomatozy afrykańskiej, podczas gdy przewidywana liczba przypadków miała wynosić 5000. Łączna liczba zgłoszonych przypadków w 2014 r. to 86-procentowy spadek w stosunku do całkowitej liczby przypadków zgłoszonych w 2000 r.
Choroba została odnotowana w 37 krajach, wszystkie w Afryce subsaharyjskiej. Występuje regularnie w południowo-wschodniej Ugandzie i zachodniej Kenii, aw 2008 r. zabiła ponad 48 000 Afrykanów. Demokratyczna Republika Konga jest najbardziej dotkniętym krajem na świecie, odpowiadając za 75% przypadków Trypanosoma brucei gambiense . Populacja zagrożona wynosi około 69 milionów, przy czym jedna trzecia tej liczby jest na „bardzo wysokim” lub „umiarkowanym” ryzyku, a pozostałe dwie trzecie na „niskim” do „bardzo niskim” ryzyku. Liczba osób dotkniętych chorobą spadła. W takim tempie eliminacja śpiączki jest możliwa. Światowa Organizacja Zdrowia planuje zlikwidować śpiączkę do 2030 roku.
| Trypanosoma brucei gambiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Angola | 1498 | 2094 | 2406 | 1796 | 1274 | 2441 | 6726 | 8275 | 6610 | 5351 | 4546 | 4577 | 3621 | 3115 | 2280 | 1727 | 1105 | 648 | 517 | 247 | 211 | 154 | 70 | 69 | 36 | 35 | 19 | 18 | 79 | 30 |
| Benin | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Burkina Faso | 27 | 27 | 20 | 17 | 18 | 13 | 12 | 1 | 15 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Kamerun | 86 | 69 | 21 | 3 | 20 | 21 | 17 | 10 | 54 | 32 | 27 | 14 | 32 | 33 | 17 | 3 | 15 | 7 | 13 | 24 | 16 | 15 | 7 | 6 | 7 | 6 | 6 | 5 | 7 | 17 |
| Republika Środkowoafrykańska | 308 | 197 | 362 | 262 | 368 | 676 | 492 | 730 | 1068 | 869 | 988 | 718 | 572 | 539 | 738 | 666 | 460 | 654 | 1194 | 1054 | 395 | 132 | 381 | 59 | 194 | 147 | 124 | 76 | 57 | 86 |
| Czad | 20 | 221 | 149 | 65 | 214 | 315 | 178 | 122 | 134 | 187 | 153 | 138 | 715 | 222 | 483 | 190 | 276 | 97 | 196 | 510 | 232 | 276 | 197 | 195 | 95 | 67 | 53 | 28 | 12 | 16 |
| Kongo | 580 | 703 | 727 | 829 | 418 | 475 | 474 | 142 | 201 | 91 | 111 | 894 | 1005 | 717 | 873 | 398 | 300 | 189 | 182 | 87 | 87 | 61 | 39 | 20 | 21 | 36 | 18 | 15 | 24 | 17 |
| Wybrzeże Kości Słoniowej | 365 | 349 | 456 | 260 | 206 | 326 | 240 | 185 | 121 | 104 | 188 | 92 | 97 | 68 | 74 | 42 | 29 | 13 | 14 | 8 | 8 | 10 | 9 | 7 | 6 | 3 | 0 | 3 | 2 | 1 |
| Demokratyczna Republika Konga | 7515 | 5825 | 7757 | 11384 | 19021 | 18182 | 19342 | 25094 | 26318 | 18684 | 16951 | 17300 | 13816 | 11459 | 10339 | 10249 | 8013 | 8155 | 7318 | 7178 | 5624 | 5590 | 5968 | 5647 | 3205 | 2351 | 1769 | 1110 | 660 | 604 |
| Gwinea Równikowa | 63 | 36 | 45 | 30 | 85 | 37 | 46 | 67 | 62 | 28 | 16 | 17 | 32 | 23 | 22 | 17 | 13 | 15 | 11 | 7 | 8 | 1 | 2 | 3 | 0 | 0 | 3 | 4 | 4 | 3 |
| Gabon | 80 | 45 | 33 | 80 | 61 | 20 | 32 | 11 | 6 | 38 | 45 | 30 | 26 | 26 | 49 | 53 | 31 | 30 | 24 | 14 | 22 | 17 | 9 | 17 | 10 | 9 | 10 | 9 | 16 | 8 |
| Ghana | 3 | 6 | 16 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Gwinea | 52 | 29 | 24 | 27 | 26 | 33 | 38 | 88 | 99 | 68 | 52 | 72 | 132 | 130 | 95 | 94 | 48 | 69 | 90 | 79 | 68 | 57 | 70 | 78 | 33 | 29 | 107 | 140 | 74 | 69 |
| Mali | 0 | 0 | 0 | 27 | 17 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nigeria | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 27 | 14 | 14 | 26 | 31 | 10 | 21 | 3 | 0 | 0 | 0 | 2 | 3 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Południowy Sudan | 67 | 58 | 28 | 62 | 69 | 56 | 157 | 737 | 1726 | 1312 | 1801 | 1919 | 3121 | 3061 | 1742 | 1853 | 789 | 469 | 623 | 373 | 199 | 272 | 317 | 117 | 63 | 45 | 17 | 12 | 17 | 11 |
| Iść | 2 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Uganda | 2066 | 1328 | 2042 | 1764 | 1469 | 1062 | 981 | 1123 | 971 | 1036 | 948 | 310 | 604 | 517 | 378 | 311 | 290 | 120 | 198 | 99 | 101 | 44 | 20 | 9 | 9 | 4 | 4 | 0 | 1 | 2 |
| Całkowity | 12756 | 10987 | 14088 | 16607 | 23266 | 23671 | 28736 | 36585 | 37385 | 27862 | 25841 | 26095 | 23799 | 19941 | 17100 | 15624 | 11372 | 10466 | 10380 | 9680 | 6973 | 6632 | 7091 | 6228 | 3679 | 2733 | 2131 | 1420 | 953 | 864 |
| Trypanosoma brucei rhodesiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
| Kenia | 91 | 8 | 4 | 2 | 1 | 0 | 2 | 5 | 14 | 22 | 15 | 10 | 11 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Malawi | 228 | 195 | 143 | 53 | 31 | 15 | 8 | 7 | 10 | 11 | 35 | 38 | 43 | 70 | 48 | 41 | 58 | 50 | 49 | 39 | 29 | 23 | 18 | 35 | 32 | 30 | 37 | 7 | 15 | 91 |
| Mozambik | 3 | 7 | 24 | 10 | 16 | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | 1 | Brak danych | 1 | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych |
| Uganda | 1417 | 832 | 606 | 503 | 342 | 497 | 178 | 217 | 283 | 283 | 300 | 426 | 329 | 338 | 335 | 473 | 261 | 119 | 138 | 129 | 112 | 84 | 71 | 43 | 70 | 28 | 10 | 13 | 4 | 5 |
| Zjednoczona Republika Tanzanii | 187 | 177 | 366 | 262 | 319 | 422 | 400 | 354 | 299 | 288 | 350 | 277 | 228 | 113 | 159 | 186 | 127 | 126 | 59 | 14 | 5 | 1 | 4 | 1 | 1 | 2 | 3 | 3 | 0 | 3 |
| Zambia | 7 | Brak danych | 4 | 1 | 1 | 1 | 3 | Brak danych | Brak danych | 15 | 9 | 4 | 5 | 15 | 9 | 7 | 6 | 10 | 13 | 4 | 8 | 3 | 6 | 6 | 12 | 8 | 2 | 3 | 5 | 15 |
| Zimbabwe | Brak danych | Brak danych | Brak danych | Brak danych | 1 | Brak danych | Brak danych | 9 | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | Brak danych | 3 | Brak danych | Brak danych | 0 | 3 | 2 | 4 | 9 | 1 | 3 | 3 | 1 | 1 | 0 | 2 |
| Całkowity | 1933 | 1219 | 1147 | 831 | 710 | 935 | 591 | 583 | 606 | 619 | 709 | 755 | 617 | 536 | 552 | 707 | 453 | 305 | 259 | 187 | 154 | 111 | 101 | 85 | 115 | 68 | 52 | 27 | 24 | 116 |
Historia

Choroba występuje w Afryce od tysięcy lat. Z powodu braku możliwości podróżowania między rdzennymi mieszkańcami, śpiączka u ludzi ograniczała się do izolowanych kieszeni. Zmieniło się to po tym, jak arabscy handlarze niewolników wkroczyli do środkowej Afryki ze wschodu, wzdłuż rzeki Kongo , przywożąc ze sobą pasożyty. Śpiączka gambijska wędrowała w górę rzeki Kongo, a następnie dalej na wschód.
Arabski pisarz z XIV wieku zostawił następujący opis w przypadku sułtana królestwa Mali: „Jego kres miała dosięgnąć śpiączka ( illat an-nawm ), która jest chorobą często dotykającą mieszkańców tych krajów, zwłaszcza ich wodzów. Sen ogarnia jednego z nich w taki sposób, że nie można go obudzić.
Brytyjski chirurg marynarki John Atkins opisał chorobę po powrocie z Afryki Zachodniej w 1734 roku:
Senna Nosówka (powszechna wśród Murzynów) nie daje żadnego innego wcześniejszego Zawiadomienia niż brak apetytu 2 lub 3 dni wcześniej; ich sen jest zdrowy, a zmysły i uczucia bardzo mało; do ciągnięcia, ocierania lub biczowania z trudem pobudzi rozsądek i moc wystarczającą do poruszania się; a Moment, w którym przestajesz bić mądrali, zostaje zapomniany, a oni znowu popadają w stan Nieprzytomności, spływając nieustannie z Ust jak w głębokim ślinie; oddychaj powoli, ale nie nierówno ani nie parskaj. Młodzi ludzie są jej bardziej podatni niż starzy; a generalnie wypowiadany wyrok to Śmierć, Prognostik rzadko zawodzi. Jeśli od czasu do czasu któryś z nich wyzdrowieje, z pewnością traci mały Powód, który miał, i zmienia się w Ideota...
Francuski chirurg marynarki Marie-Théophile Griffon du Bellay leczył i opisywał przypadki, gdy stacjonował na pokładzie statku szpitalnego Caravane w Gabonie pod koniec lat 60. XIX wieku.
W 1901 r. w Ugandzie wybuchła niszczycielska epidemia, w której zginęło ponad 250 000 ludzi, w tym około dwóch trzecich populacji dotkniętych obszarów nadbrzeżnych. Według The Cambridge History of Africa „Oszacowano, że nawet połowa ludzi zmarła na śpiączkę i ospę na ziemiach po obu stronach dolnego Konga ”.
Czynnik sprawczy i wektor zostały zidentyfikowane w 1903 przez Davida Bruce'a , a podgatunki pierwotniaków zostały zróżnicowane w 1910. Bruce wcześniej wykazał, że T. brucei był przyczyną podobnej choroby u koni i bydła przenoszonej przez muchę tse - tse ( Glossina morsitans ).
Pierwsza skuteczna terapia, atoksyl , lek na bazie arsenu , opracowany przez Paula Ehrlicha i Kiyoshi Shiga , wprowadzono w 1910 roku, ale ślepota była poważnym skutkiem ubocznym.
Suramin został po raz pierwszy zsyntetyzowany przez Oskara Dressela i Richarda Kothe w 1916 roku dla firmy Bayer . Został wprowadzony w 1920 roku w celu leczenia pierwszego stadium choroby. W 1922 r. suraminę łączono na ogół z tryparsamidem (innym pięciowartościowym lekiem organoarsenowym), pierwszym lekiem, który wchodzi do układu nerwowego i jest przydatny w leczeniu drugiego stadium postaci gambiense. Tryparsamid został ogłoszony w Journal of Experimental Medicine w 1919 roku i przetestowany w Kongo Belgijskim przez Louise Pearce z Instytutu Rockefellera w 1920 roku. Był używany podczas wielkiej epidemii w Afryce Zachodniej i Środkowej na milionach ludzi i był podstawą terapii do lata sześćdziesiąte. Amerykański misjonarz medyczny Arthur Lewis Piper był aktywny w stosowaniu tryparsamidu w leczeniu śpiączki w Kongo Belgijskim w 1925 roku.
Pentamidyna , wysoce skuteczny lek w pierwszym stadium choroby, jest stosowany od 1937 roku. W latach pięćdziesiątych była szeroko stosowana jako środek profilaktyczny w Afryce Zachodniej, prowadząc do gwałtownego spadku liczby infekcji. W tamtym czasie uważano, że zwalczenie choroby jest na wyciągnięcie ręki.
Arsenoorganiczne melarsoprol (Arsobal) opracowany w 1940 roku jest skuteczna dla osób z drugiego etapu spania choroby. Jednak 3–10% wstrzykniętych ma encefalopatię reaktywną (drgawki, postępująca śpiączka lub reakcje psychotyczne), a 10–70% takich przypadków kończy się śmiercią; może powodować uszkodzenie mózgu u tych, którzy przeżyli encefalopatię. Jednak ze względu na swoją skuteczność melarsoprol jest nadal stosowany. Wzrasta oporność na melarsoprol i obecnie prowadzone są badania nad terapią skojarzoną z nifurtimoxem.
Eflornityna (difluorometyloornityna lub DFMO), najnowocześniejsza metoda leczenia, została opracowana w latach 70. przez Alberta Sjoerdsmę i przeszła badania kliniczne w latach 80. XX wieku. Lek został zatwierdzony przez Amerykańską Agencję ds. Żywności i Leków w 1990 roku. Aventis , firma odpowiedzialna za jego produkcję, wstrzymała produkcję w 1999 roku. W 2001 roku Aventis, we współpracy z Lekarzami bez Granic i Światową Organizacją Zdrowia , podpisał długoletni umowa terminowa na produkcję i oddanie leku.
Oprócz śpiączki, poprzednie nazwy obejmowały letarg murzyński, maladie du sommeil (Fr), Schlafkrankheit (Niemcy), afrykański letarg i trypanosomatozę Konga.
- Kierowana przez Brytyjczyków Komisja ds. Śpiącej Choroby zbierająca muchy tse-tse, Uganda i Nyasaland , 1908-1913
Badania
Zsekwencjonowano genom pasożyta i zidentyfikowano kilka białek jako potencjalne cele leczenia farmakologicznego. Analiza genomu ujawniła również, dlaczego stworzenie szczepionki na tę chorobę było tak trudne. T. brucei ma ponad 800 genów, które sprawiają, że białka pasożytów „mieszają się i dopasowują”, aby uniknąć wykrycia przez układ odpornościowy.
Wykorzystanie genetycznie zmodyfikowanej formy bakterii, która naturalnie występuje w jelitach wektorów, jest badane jako metoda kontrolowania choroby.
Ostatnie odkrycia wskazują, że pasożyt nie jest w stanie przetrwać w krwiobiegu bez wici . Ten wgląd daje naukowcom nowy punkt widzenia na atakowanie pasożyta.
Trwają badania nad szczepionkami przeciwko trypanosomatozie .
Ponadto inicjatywa Drugs for Neglected Disease Initiative przyczyniła się do badań nad śpiączką afrykańską, opracowując związek o nazwie feksinidazol . Projekt ten został pierwotnie rozpoczęty w kwietniu 2007 roku i objął 749 osób w DRK i Republice Środkowoafrykańskiej . Wyniki wykazały skuteczność i bezpieczeństwo w obu stadiach choroby, zarówno u dorosłych, jak i dzieci w wieku ≥ 6 lat i masie ciała ≥ 20 kg. Europejska Agencja Leków zatwierdziła go na pierwszym i drugim stadium choroby spoza Europy w listopadzie 2018. Zabieg został zatwierdzony w DRK w grudniu 2018 r.
Finansowanie
Według aktualnych statystyk finansowania, ludzka trypanosomatoza afrykańska jest pogrupowana z infekcjami kinetoplastyd. Kinetoplastydy odnoszą się do grupy pierwotniaków wiciowców. Infekcje kinetoplastydowe obejmują śpiączkę afrykańską, chorobę Chagasa i leiszmaniozę. W sumie te trzy choroby odpowiadały za 4,4 miliona lat życia skorygowanych niepełnosprawnością (DALY) i dodatkowe 70 075 odnotowanych zgonów rocznie. W przypadku infekcji kinetoplastydami całkowite globalne finansowanie badań i rozwoju wyniosło w 2012 roku około 136,3 miliona dolarów. Każda z trzech chorób, śpiączka afrykańska, choroba Chagasa i leiszmanioza, otrzymała około jednej trzeciej środków, czyli około 36,8 miliona dolarów amerykańskich. , odpowiednio 38,7 mln USD i 31,7 mln USD.
W przypadku śpiączki fundusze zostały podzielone na badania podstawowe, odkrywanie leków, szczepionki i diagnostykę. Najwięcej środków przeznaczono na podstawowe badania choroby; na ten wysiłek przeznaczono około 21,6 miliona dolarów amerykańskich. Jeśli chodzi o rozwój terapeutyczny, zainwestowano około 10,9 miliona dolarów.
Głównym podmiotem finansującym badania i rozwój w zakresie infekcji kinetoplastydami są źródła publiczne. Około 62% środków pochodzi z krajów o wysokich dochodach, a 9% z krajów o niskich i średnich dochodach. Finansowanie publiczne krajów o wysokim dochodzie jest największym wkładem w wysiłki badawcze nad zaniedbanymi chorobami. Jednak w ostatnich latach finansowanie z krajów o wysokim dochodzie stale spada; w 2007 r. kraje o wysokim dochodzie zapewniły 67,5% całkowitego finansowania, podczas gdy w 2012 r. środki publiczne krajów o wysokim dochodzie zapewniły jedynie 60% całkowitego finansowania zakażeń kinetoplastydami. Ten trend spadkowy pozostawia lukę do wypełnienia dla innych fundatorów, takich jak fundacje filantropijne i prywatne firmy farmaceutyczne.
Znaczna część postępu, jaki poczyniono w badaniach nad śpiączką afrykańską i zaniedbanymi chorobami jako całości, jest wynikiem innych niepublicznych fundatorów. Jednym z tych głównych źródeł finansowania są fundacje, które w XXI wieku coraz bardziej angażują się w odkrywanie zaniedbanych leków na choroby. W 2012 r. źródła filantropijne zapewniły 15,9% całości finansowania. Fundacja Billa i Melindy Gatesów jest liderem w finansowaniu rozwoju leków na zaniedbane choroby. W 2012 roku przekazali 444,1 miliona dolarów na badania nad zaniedbanymi chorobami. Do tej pory przekazali ponad 1,02 miliarda dolarów na badania nad zaniedbanymi chorobami.
W szczególności w przypadku infekcji kinetoplastydami przekazali średnio 28,15 mln USD rocznie w latach 2007-2011. Określili ludzką trypanosomatozę afrykańską jako cel wysokiej szansy, co oznacza, że jest to choroba, która daje największą szansę na kontrolę, eliminację i zwalczanie poprzez opracowywanie nowych leków, szczepionek, programów zdrowia publicznego i diagnostyki. Są drugim co do wielkości źródłem finansowania zaniedbanych chorób, zaraz za amerykańskimi Narodowymi Instytutami Zdrowia. W czasach, gdy fundusze publiczne maleją, a dotacje rządowe na badania naukowe są trudniejsze do uzyskania, świat filantropijny wkroczył, aby popchnąć badania do przodu.
Inny ważny składnik zwiększonego zainteresowania i finansowania pochodzi z przemysłu. W 2012 r. wnieśli 13,1% ogółu do prac badawczo-rozwojowych nad kinetoplastydami, a ponadto odegrali ważną rolę, przyczyniając się do partnerstw publiczno-prywatnych (PPP) oraz partnerstw na rzecz rozwoju produktów (PDP). Partnerstwo publiczno-prywatne to porozumienie między co najmniej jednym podmiotem publicznym a co najmniej jednym podmiotem prywatnym, które istnieje w celu osiągnięcia określonego wyniku zdrowotnego lub wytworzenia produktu zdrowotnego. Partnerstwo może istnieć na wiele sposobów; mogą udostępniać i wymieniać fundusze, mienie, sprzęt, zasoby ludzkie i własność intelektualną. Te partnerstwa publiczno-prywatne i partnerstwa na rzecz rozwoju produktów zostały ustanowione w celu sprostania wyzwaniom w przemyśle farmaceutycznym, zwłaszcza związanym z zaniedbanymi badaniami nad chorobami. Te partnerstwa mogą pomóc zwiększyć skalę wysiłków na rzecz rozwoju terapeutycznego poprzez wykorzystanie różnej wiedzy, umiejętności i ekspertyz z różnych źródeł. Wykazano, że tego typu partnerstwa są bardziej efektywne niż niezależne grupy branżowe lub publiczne.
Inne zwierzęta i zbiornik
Trypanosoma zarówno typu rhodesiense, jak i gambiense może wpływać na inne zwierzęta, takie jak bydło i dzikie zwierzęta. Trypanosomatoza afrykańska jest ogólnie uważana za chorobę antroponotyczną, dlatego jej program kontroli koncentrował się głównie na zatrzymaniu transmisji poprzez leczenie przypadków u ludzi i wyeliminowanie wektora. Jednak stwierdzono, że zbiorniki zwierzęce prawdopodobnie odgrywają ważną rolę w endemicznej naturze afrykańskiej trypanosomatozy i jej odrodzeniu w historycznych ogniskach Afryki Zachodniej i Środkowej.
Bibliografia
Zewnętrzne linki
| Scholia ma profil tematyczny dotyczący trypanosomatozy afrykańskiej . |
- „Marzenie lekarza” . historie.dndi.org . Źródło 14 maja 2020 .
- „Śpiączka” . Lekarze bez granic . Zarchiwizowane od oryginału w dniu 23 października 2013 r.
- Linki do zdjęć śpiącej choroby (Hardin MD/ University of Iowa )
- Hale Carpenter G (1920). Przyrodnik nad Jeziorem Wiktorii, opowiadający o śpiączce i muchie Tse-tse . Wygraj. OCLC 2649363 .
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |