Tolkapon - Tolcapone
 | |
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Tasmar |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a698036 |
| Dane licencyjne | |
Kategoria ciąży |
|
| Drogi podania |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | 65% |
| Wiązanie białek | > 99,9% |
| Metabolizm | Wątroba (głównie glukuronidacja) |
| Okres półtrwania w fazie eliminacji | 2-3 godziny |
| Wydalanie | Mocz (60%), kał (40%); tylko 0,5% w postaci niezmetabolizowanej |
| Identyfikatory | |
| |
| Numer CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Ligand PDB | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.222.604 |
| Dane chemiczne i fizyczne | |
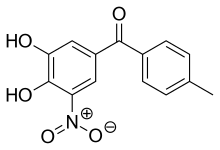
| Formuła | C 14 H 11 N O 5 |
| Masa cząsteczkowa | 273,244 g · mol −1 |
| Model 3D ( JSmol ) | |
| Temperatura topnienia | Od 143 do 146 ° C (od 289 do 295 ° F) |
| Rozpuszczalność w wodzie | nierozpuszczalny |
| |
| |
| (zweryfikować) | |
Tolkapon , sprzedawany pod marką Tasmar , to lek stosowany w leczeniu choroby Parkinsona (PD). Jest selektywnym, silnym i odwracalnym inhibitorem enzymu katecholo- O- metylotransferazy (COMT) typu nitrokatechiny . Wykazał znaczną toksyczność dla wątroby, co doprowadziło do zawieszenia pozwoleń na dopuszczenie do obrotu w wielu krajach.
W porównaniu z entakaponem , innym nitrokatecholowym inhibitorem COMT, tolkapon ma dłuższy okres półtrwania (2,9 godziny w porównaniu z 0,8 godziny) i może lepiej przenikać przez barierę krew-mózg , działając zarówno w ośrodkowym układzie nerwowym, jak i na obwodzie. Jednak entakapon jest mniej toksyczny dla wątroby.

Zastosowania medyczne
Tolkapon jest stosowany w leczeniu choroby Parkinsona jako uzupełnienie leków zawierających lewodopę / karbidopę lub lewodopę / benzerazyd . Lewodopy jest prolekiem w dopaminę , która zmniejsza objawy Parkinsona; karbidopa i benzerazyd są aromatycznymi inhibitorami dekarboksylazy L- aminokwasów (AADC).
Bez podania tolkaponu korzystne działanie lewodopy ma tendencję do szybszego zaniku, co prowadzi do fluktuacji motorycznych.
Przeciwwskazania
Łączenie tolkaponu z nieselektywnymi inhibitorami monoaminooksydazy, takimi jak fenelzyna lub tranylcypromina, jest przeciwwskazane. Tolkapon jest również przeciwwskazany u osób z chorobami wątroby lub zwiększoną aktywnością enzymów wątrobowych .
Skutki uboczne
Tolkapon wykazał znaczną toksyczność wątroby (hepatotoksyczność), która ogranicza użyteczność leku. Entakapon jest alternatywą, głównie ze względu na korzystniejszy profil toksyczności.
Hepatotoksyczność może być związana z podwyższonym poziomem transaminaz , ale badania wykazały, że istnieje minimalne ryzyko dla osób bez wcześniejszych chorób wątroby, gdy monitorowano ich poziomy enzymów. Nie ma tu żadnego wyraźnego mechanizmu, ale postawiono hipotezę, że ma to coś wspólnego z nieprawidłowym oddychaniem mitochondrialnym w wyniku rozprzęgania fosforylacji oksydacyjnej .
Inne skutki uboczne dotyczą wzrostu aktywności dopaminergicznej, w tym objawów ze strony przewodu pokarmowego. Leczenie tolkaponem stwarza ryzyko wywołania lub przedłużenia dyskinez ; można temu przeciwdziałać, zmniejszając dawkę lewodopy. Dzieje się tak, ponieważ podawanie tolkaponu powoduje gromadzenie się w prążkowiu biologicznego S -adenozylo- L- metioniny (SAM) donora grupy metylowej, która wywołuje objawy choroby Parkinsona.
Objawy trawienne obejmują nudności i biegunkę ; dalsze dopaminergiczne skutki uboczne obejmują ortostatyczne niedociśnienie , suchość w ustach, pocenie się i zawroty głowy. Tolkapon powoduje cięższą biegunkę niż entakapon; był to najczęstszy powód zakończenia terapii w badaniach. Przebarwienia moczu są spowodowane wydalaniem żółtych metabolitów tolkaponu z moczem i są nieszkodliwe.
Interakcje
Podczas gdy wzrost poziomu dopaminy jest pożądaną interakcją, tolkapon może teoretycznie również zwiększać poziomy innych leków metabolizowanych przez COMT, takich jak inhibitory AADC karbidopa i benzerazyd, a także metylodopa , dobutamina , apomorfina , adrenalina i izoprenalina . W badaniach obserwowano niewielką interakcję z benzerazydem, ale nie z karbidopą. Nie badano innych interakcji z tą grupą leków. Podobnym rodzajem interakcji teoretycznych są leki, które zwiększają stężenie katecholamin , takie jak inhibitory monoaminooksydazy (MAO) i inhibitory wychwytu zwrotnego noradrenaliny ; te również wykazały jedynie niewielkie efekty w praktyce. Połączenie z nieselektywnymi inhibitorami MAO może być niebezpieczne.
Ze względu na jego powinowactwo do enzymu wątrobowego CYP2C9 , możliwe są również interakcje z lekami metabolizowanymi przez ten enzym, ale są one mało prawdopodobne. W badaniach nie obserwowano interakcji z tolbutamidem , substratem 2C9 .
Farmakologia
Mechanizm akcji
Tolkapon wiąże się wybiórczo i odwracalnie z miejscem katalitycznym COMT zarówno na obwodzie, jak iw ośrodkowym układzie nerwowym (OUN) z większym powinowactwem niż którakolwiek z trzech amin katecholowych , w tym lewodopy. W ten sposób zapobiega 3- O- metylacji lewodopy przez COMT na obwodzie, co prowadzi do powstania 3- O- metylodopy, głównego metabolitu, który konkuruje z lewodopą o przekraczanie bariery krew-mózg . Więcej podawanej lewodopy dociera do OUN. Ponadto lewodopa, która już dotarła do OUN, po przekształceniu w dopaminę, nie będzie rozkładana tak szybko, gdy tolkapon hamuje aktywność COMT. Zatem tolkapon poprawia biodostępność i zmniejsza klirens lewodopy, a następnie dopaminy z OUN.
Siła powinowactwa wiązania tolkapon, reprezentowany przez stałą hamowania K I (2,5 nM), można traktować jako stałą dysocjacji dla kompleksu enzymu i inhibitora kinetyki. Maksymalna aktywność katalityczna oznacza skuteczność tolkaponu (V max = 58,4 pmol / min · mg).
Farmakokinetyka
Tolkapon jest szybko wchłaniany z jelit do około 85%. Ma absolutną biodostępność 65%, która jest tylko nieznacznie zmniejszona, gdy jest przyjmowany z jedzeniem. Substancja osiąga najwyższe stężenie w osoczu krwi po około dwóch godzinach. W krwiobiegu prawie całkowicie (> 99,9%) wiąże się z białkami osocza , głównie z albuminami . Głównym etapem inaktywacji jest glukuronidacja ; inne procesy to metylacja przez COMT, hydroksylacja przez CYP3A4 i CYP2A6 z późniejszym utlenianiem do kwasu karboksylowego i prawdopodobnie mniej istotna ścieżka z redukcją do aminy z późniejszą acetylacją .
Okres półtrwania tolkaponu jest od dwóch do trzech godzin, objętość dystrybucji (V d ) są 0,3 l / kg (w 21 L w przeciętnej osoby o wadze 70 kg). 60% metabolitów jest wydalane z moczem, a 40% z kałem. Tylko 0,5% leku jest wydalane w postaci niezmienionej z moczem.
99% tolkaponu w Mono anionowego formy w ciele, ponieważ przy fizjologicznym pH wynosi 7,4. Tolkapon przenika przez barierę krew-mózg znacznie lepiej niż dwa inne nitrokatechole, nitekapon i entakapon , ponieważ ma wyższą lipofilowość dzięki podstawnikowi R. Współczynniki podziału określają ilościowo zdolność cząsteczki do przekraczania bariery krew-mózg. LogPIdce = 0,2, –1,4, –0,4 odpowiednio dla tolkaponu, nitekaponu i entakoponu. Współczynniki podziału na tym przypadku mierzono w 1,2-dichloroetan / H 2 O roztworu, który spowodował cząsteczki być w formie zjonizowanej. Obecnie nie ma wyjaśnienia, w jaki sposób te naładowane cząsteczki przenikają przez barierę krew-mózg.
Chemia
Tolkapon to intensywnie żółty, bezwonny, gorzki w smaku, niehigroskopijny , krystaliczny związek o względnej masie cząsteczkowej 273,25 g / mol. Topi się w temperaturze od 143 do 146 ° C (289 do 295 ° F), jest praktycznie nierozpuszczalny w wodzie i kwasach, ale rozpuszczalny w 0,1 M wodnym roztworze wodorotlenku sodu. W P K a wartości 4,5 i 10,6 dla dwóch fenylowych grupy; a maksymalna absorpcja przy 268 nm (w 0,1 M kwasie solnym / etanolu). Jego nazwa chemiczna to 3,4-dihydroksy-4'-metylo-5-nitrobenzofenon.
Synteza
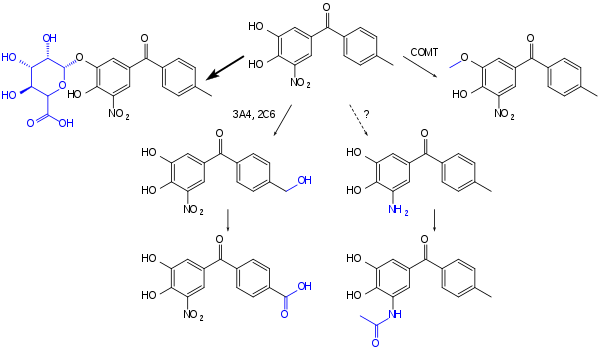
Zaproponowana w 2008 r. Synteza tolkaponu rozpoczyna się od reakcji Grignarda pomiędzy pochodną benzaldehydu a bromkiem p- tolilomagnezu. Powstały w ten sposób alkohol przekształca się następnie w keton przy użyciu t -butanolanu sodu . Benzylową grupę zabezpieczającą usuwa się przez palladu katalizowanej przez uwodornienie w obecności mrówczanu amonu. Grupa nitrowa jest wprowadzana w pozycji 5 sąsiadującej z grupą hydroksylową, która została zdemaskowana podczas rozszczepiania eteru benzylowego. Synteza kończy się odszczepieniem grupy metoksylowej przy użyciu chlorku glinu z wytworzeniem alkoholu.
Historia
Tolkapon został wprowadzony na rynek europejski w sierpniu 1997 r., A następnie na rynek w Stanach Zjednoczonych w marcu 1998 r. Toksyczność wątroby stwierdzono u czterech osób, którym podano tolkapon, trzy osoby zmarły z powodu powikłań. W konsekwencji pozwolenie na dopuszczenie do obrotu tolkaponu zostało zawieszone od grudnia 1998 r. Do sierpnia 2004 r., Kiedy to zostało zniesione. W listopadzie 1998 r. Firma produkująca tolkapon dobrowolnie wycofała lek z rynku. Zezwolenie zostało następnie odnowione w sierpniu 2009 r.
W wyniku zgłoszonych powikłań amerykańska Agencja ds. Żywności i Leków (FDA) wydała ostrzeżenie w postaci czarnej skrzynki dotyczące tolkaponu i rewizji etykiet, które miały na celu uregulowanie monitorowania przepisanego tolkaponu w chorobie Parkinsona w listopadzie 1998 r. Wiele innych krajów wycofało tolkapon z rynku; Australia w lutym 1999 r., Bułgaria w kwietniu 1999 r., Islandia w listopadzie 1998 r., Litwa w grudniu 1998 r.
Badania
Ze względu na wstępne dane sugerujące, że lek może wykazywać aktywność, amerykańska FDA przyznała tolkaponowi status „leku sierocego” w badaniach mających na celu leczenie rodzinnej amyloidozy transtyretyny (ATTR). Jednak tolkapon nie jest zatwierdzony przez FDA do leczenia tej choroby.
Bibliografia
Linki zewnętrzne
- „Tołkapon” . Portal informacji o lekach . US National Library of Medicine.