Infekcja tęgoryjcem - Hookworm infection
| Infekcja tęgoryjca | |
|---|---|
| Inne nazwy | Choroba tęgoryjca |
 | |
| Tęgoryjec | |
| Specjalność | Choroba zakaźna |
| Objawy | Swędzenie, miejscowa wysypka, ból brzucha, biegunka |
| Komplikacje | Niedokrwistość , niedobór białka |
| Powoduje | Ancylostoma dwunastnica (tęgoryjca starego świata), Necator americanus (tęgoryjca nowego świata) |
| Czynniki ryzyka | Chodzenie boso w ciepłym klimacie o złych warunkach sanitarnych |
| Metoda diagnostyczna | Próbka kału |
| Zapobieganie | Nie chodzenie boso, zatrzymanie defekacji na świeżym powietrzu |
| Lek | Albendazol , mebendazol , suplementy żelaza |
| Częstotliwość | 428 mln (2015) |
Infekcja tęgoryjcem to infekcja przez rodzaj pasożyta jelitowego zwanego tęgoryjcem . Początkowo w miejscu infekcji może wystąpić swędzenie i wysypka. Osoby dotknięte tylko kilkoma robakami mogą nie wykazywać żadnych objawów. Osoby zarażone wieloma robakami mogą odczuwać ból brzucha , biegunkę, utratę wagi i zmęczenie . Może to mieć wpływ na rozwój psychiczny i fizyczny dzieci. Może to spowodować niedokrwistość .
Dwa typowe tęgoryjec infekcje u ludzi są ankylostomatoza i necatoriasis , spowodowanego przez gatunki Ancylostoma duodenale i Necator americanus odpowiednio. Jaja tęgoryjca odkładają się w stolcu zarażonych osób. Jeśli trafią do środowiska, mogą wykluć się z larw (niedojrzałych robaków), które następnie mogą przeniknąć przez skórę. Jeden rodzaj może być również przenoszony przez skażoną żywność. Czynniki ryzyka obejmują chodzenie boso w ciepłym klimacie, gdzie warunki sanitarne są słabe. Diagnoza polega na badaniu próbki kału pod mikroskopem .
Chorobie można zapobiegać na poziomie indywidualnym, nie chodząc boso w miejscach, w których choroba jest powszechna. Na poziomie populacji skuteczne jest zmniejszenie defekacji na zewnątrz , niestosowanie surowego kału jako nawozu i masowe odrobaczanie . Leczenie odbywa się zazwyczaj lekami albendazolem lub mebendazolem przez jeden do trzech dni. Suplementy żelaza mogą być potrzebne u osób z anemią.
W 2015 roku tęgoryjce zainfekowały około 428 milionów ludzi. Ciężkie infekcje mogą wystąpić zarówno u dzieci, jak i dorosłych, ale są mniej powszechne u dorosłych. Rzadko są śmiertelne. Infekcja tęgoryjcem jest robaczycą przenoszoną przez glebę i jest klasyfikowana jako zaniedbana choroba tropikalna .
Symptomy i objawy
Żadne objawy ani oznaki nie są specyficzne dla infekcji tęgoryjcem, ale powodują połączenie zapalenia jelit i postępującej niedokrwistości z niedoboru żelaza i niedoboru białka . Kaszel, ból w klatce piersiowej, świszczący oddech i gorączka czasami wynikają z ciężkiej infekcji. Bóle w nadbrzuszu, niestrawność, nudności, wymioty , zaparcia i biegunka mogą również wystąpić wcześnie lub w późniejszych stadiach, chociaż objawy żołądkowo-jelitowe mają tendencję do ustępowania z czasem. Oznaki zaawansowanej ciężkiej infekcji to niedokrwistość i niedobór białka, w tym wyniszczenie , niewydolność serca i wzdęcie brzucha z wodobrzuszem .
Larw inwazja skóry (głównie w Ameryce) może produkować choroby skóry zwany zespół larwy skórnej wędrującej znane także jako pełzanie erupcji. Żywicielami tych robaków nie są ludzie, a larwy mogą penetrować tylko pięć górnych warstw skóry, gdzie powodują intensywne, miejscowe swędzenie , zwykle na stopie lub podudziu, znane jako swędzenie podłoża . Ta infekcja jest spowodowana przez larwy tęgoryjca A. braziliense . Larwy migrują w krętych tunelach między warstwą podstawną a warstwą rogową skóry, powodując serpiginalne zmiany pęcherzykowe . Wraz z postępującym ruchem larw tylne części zmian stają się suche i chrupiące. Zmiany są zazwyczaj intensywnie swędzące.
Okres wylęgania
Okres inkubacji może wahać się od kilku tygodni do wielu miesięcy i jest w dużej mierze zależny od liczby pasożytów tęgoryjców, którymi zarażony jest osobnik.
Przyczyna
Infekcje tęgoryjców u ludzi obejmują anylostomizę i nekatoriazę . Ancylostomoza jest wywoływana przez Ancylostoma duodenale , który jest bardziej powszechnym typem występującym na Bliskim Wschodzie , w Afryce Północnej , Indiach i (dawniej) w południowej Europie . Nekatoriaz jest wywoływany przez Necator americanus , bardziej rozpowszechniony typ w obu Amerykach , Afryce Subsaharyjskiej , Azji Południowo-Wschodniej , Chinach i Indonezji .
Inne zwierzęta, takie jak ptaki , psy i koty, również mogą być dotknięte. A. tubaeforme zakaża koty, A. caninum zakaża psy, a A. braziliense i Uncinaria stenocephala zakażają zarówno koty, jak i psy. Niektóre z tych infekcji mogą być przenoszone na ludzi .
Morfologia
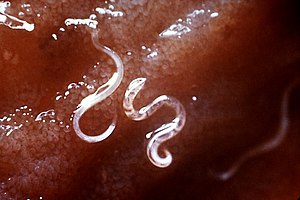
A. dwunastnicy są szarobiałe lub różowawe, z lekko pochyloną głową w stosunku do reszty ciała. To zagięcie tworzy ostateczny kształt haka na przednim końcu, od którego nazwano tęgoryjce. Posiadają dobrze rozwinięte usta z dwiema parami zębów. Podczas gdy samce mierzą około jednego centymetra na 0,5 milimetra, samice są często dłuższe i grubsze. Dodatkowo samce można odróżnić od samic na podstawie obecności wydatnej tylnej kopulacyjnej kaletki.
N. americanus jest bardzo podobny morfologicznie do A. duodenale . N. americanus jest na ogół mniejszy niż A. duodenale, przy czym samce mają zwykle długość od 5 do 9 mm, a samice około 1 cm. Podczas gdy A. duodenale posiada dwie pary zębów, N. americanus posiada parę płytek tnących w torebce policzkowej. Dodatkowo kształt haczyka jest znacznie bardziej zdefiniowany w Necator niż w Ancylostoma .
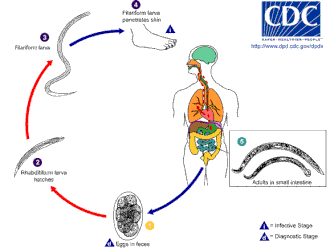
Koło życia
Tęgoryjec najlepiej rozwija się w ciepłej glebie, gdzie temperatury przekraczają 18°C. Występują głównie w glebie piaszczystej lub gliniastej i nie mogą żyć w glinie ani mule. Aby przetrwać, średnie opady deszczu muszą wynosić ponad 1000 mm (40 cali) rocznie. Tylko wtedy, gdy istnieją takie warunki, jaja mogą się wykluć. Zakaźne larwy N. americanus mogą przetrwać w wyższych temperaturach, podczas gdy larwy A. duodenale są lepiej przystosowane do chłodniejszych klimatów. Na ogół żyją tylko kilka tygodni w warunkach naturalnych i giną niemal natychmiast po wystawieniu na bezpośrednie działanie promieni słonecznych lub wysuszenie .
Zakażenie żywiciela następuje przez larwy, a nie jaja. Chociaż A. duodenale można połknąć, zwykłą metodą zakażenia jest przez skórę; jest to zwykle spowodowane chodzeniem boso po obszarach skażonych kałem. Larwy są w stanie przeniknąć przez skórę stopy, a po wejściu do ciała migrują przez układ naczyniowy do płuc , a stamtąd do tchawicy i są połykane. Następnie przechodzą przez przełyk i wchodzą do układu pokarmowego, kończąc swoją podróż w jelicie , gdzie larwy dojrzewają do postaci dorosłych robaków.
Po dostaniu się do jelita żywiciela Necator ma tendencję do wywoływania przedłużonej infekcji, zwykle od 1 do 5 lat (wiele robaków ginie w ciągu roku lub dwóch od zarażenia), chociaż odnotowano, że niektóre dorosłe robaki żyją przez 15 lat lub dłużej. Dorosłe Ancylostoma żyją krótko, żyją średnio tylko około 6 miesięcy. Jednak infekcja może się przedłużyć, ponieważ uśpione larwy mogą być „rekrutowane” sekwencyjnie z „magazynów” tkanek (patrz Patologia, powyżej) przez wiele lat, aby zastąpić przeterminowane dorosłe robaki. Może to prowadzić do sezonowych wahań w częstości występowania i intensywności infekcji (oprócz normalnych sezonowych wahań w przenoszeniu).

Kojarzą się wewnątrz gospodarza, samice składają do 30 000 jaj dziennie i około 18 do 54 milionów jaj w ciągu swojego życia, które wydalają się w kale. Ponieważ dorosłe robaki potrzebują 5 do 7 tygodni, aby dojrzeć, kojarzyć się i wydać jaja, we wczesnych stadiach bardzo ciężkiej infekcji, ostre objawy mogą wystąpić bez wykrycia jaj w kale pacjenta. To może bardzo utrudnić diagnozę.
Jaja N. americanus i A. duodenale można znaleźć w ciepłej, wilgotnej glebie, gdzie ostatecznie wylęgają się larwy pierwszego stadium, czyli L1. L1, żerujący na nieinfekcyjnym stadium rabditoformy, będzie żywił się drobnoustrojami glebowymi i ostatecznie przekształci się w larwy drugiego stadium, L2, które również są w stadium rabditoformy. Będzie żywić się przez około 7 dni, a następnie przerodzić się w larwy trzeciego stadium, czyli L3. Jest to filariowate stadium pasożyta, czyli nieżywiąca się zakaźna forma larw. Larwy L3 są niezwykle ruchliwe i szukają wyższego gruntu, aby zwiększyć swoje szanse na przeniknięcie skóry żywiciela ludzkiego. Larwy L3 mogą przetrwać do 2 tygodni bez znalezienia żywiciela. Podczas gdy larwy N. americanus infekują tylko poprzez penetrację skóry, A. duodenale może infekować zarówno poprzez penetrację, jak i doustnie. Po pomyślnym wniknięciu larw L3 do żywiciela, przemieszczają się one przez żyłki podskórne i naczynia limfatyczne żywiciela ludzkiego. Ostatecznie larwy L3 przedostają się do płuc przez naczynia włosowate płucne i przedostają się do pęcherzyków płucnych. Następnie przemieszczają się w górę tchawicy, aby zostać zakaszlanymi i połkniętymi przez gospodarza. Po połknięciu larwy L3 są następnie znajdowane w jelicie cienkim, gdzie przetapiają się w stadium L4 lub dorosłego robaka. Cały proces od penetracji skóry do rozwoju dorosłego trwa około 5-9 tygodni. Dorosłe samice robaków uwalniają jajeczka ( N. americanus około 9 000–10 000 jaj/dzień i A. duodenale 25 000–30 000 jaj/dzień), które są wydalane z kałem gospodarza ludzkiego. Te jaja wylęgają się w środowisku w ciągu kilku dni, a cykl zaczyna się od nowa.
Patofizjologia
Infekcja tęgoryjca jest ogólnie uważana za bezobjawową, ale jak opisał Norman Stoll w 1962 roku, jest to niezwykle niebezpieczna infekcja, ponieważ jej uszkodzenie jest „ciche i podstępne”. Osoba może odczuwać ogólne objawy wkrótce po zakażeniu. Swędzenie ziemi, które jest reakcją alergiczną w miejscu penetracji i wniknięcia pasożyta, jest powszechne u pacjentów zakażonych N. americanus . Dodatkowo może wystąpić kaszel i zapalenie płuc, gdy larwy zaczną włamywać się do pęcherzyków i przemieszczać się w górę tchawicy. Następnie, gdy larwy dotrą do jelita cienkiego żywiciela i zaczną dojrzewać, zarażona osoba będzie cierpieć z powodu biegunki i innych dolegliwości żołądkowo-jelitowych. Jednak „ciche i podstępne” objawy, o których wspomina Stoll, są związane z przewlekłymi, intensywnymi infekcjami tęgoryjcami. Główna zachorowalność związana z infekcją tęgoryjca jest spowodowana utratą krwi jelitowej, niedokrwistością z niedoboru żelaza i niedożywieniem białkowym. Wynikają one głównie z tego, że dorosłe tęgoryjce w jelicie cienkim połykają krew, rozrywają erytrocyty i rozkładają hemoglobinę u gospodarza. Ta długotrwała utrata krwi może objawiać się fizycznie poprzez obrzęk twarzy i obwodowy ; eozynofilia i pica spowodowane niedokrwistością z niedoboru żelaza występują również u niektórych pacjentów zakażonych tęgoryjcami. Ostatnio więcej uwagi poświęcono innym ważnym skutkom infekcji tęgoryjcem, które odgrywają dużą rolę w zdrowiu publicznym. Obecnie powszechnie przyjmuje się, że dzieci cierpiące na przewlekłą infekcję tęgoryjcem mogą cierpieć z powodu opóźnienia wzrostu, a także upośledzenia umysłowego i poznawczego. Ponadto ostatnie badania koncentrowały się na potencjalnych niekorzystnych skutkach dla matki i płodu, gdy matka jest zarażona tęgoryjcem w czasie ciąży.
Choroba była związana z nicieniami ( Ankylostoma duodenalis ) o długości od jednej trzeciej do pół cala w jelicie, głównie dzięki pracy Theodora Bilharza i Griesingera w Egipcie (1854).
Objawy mogą być związane ze stanem zapalnym w jelitach stymulowane przez karmienie tęgoryjce, takich jak nudności, bóle brzucha i przerywanym biegunki i do postępującego niedokrwistości przedłużonym Disease kapryśnej apetytu Pica (lub brud jedzenia), uporczywe zaparcia następnie biegunki , kołatanie serca , nitkowaty puls, chłód skóry, bladość błon śluzowych, zmęczenie i osłabienie, duszność, aw przypadkach zgonu, czerwonka , krwotoki i obrzęki . Robaki wysysają krew i uszkadzają błonę śluzową . Jednak utrata krwi w stolcu nie jest wyraźnie widoczna.
Badania krwi we wczesnej infekcji często wykazują wzrost liczby eozynofili, rodzaju białych krwinek, które są preferencyjnie stymulowane przez infekcje tkanek przez robaki (duża liczba eozynofilów jest również obecna w miejscowej odpowiedzi zapalnej). Spadek poziomu hemoglobiny we krwi będzie widoczny w przypadku przedłużającej się infekcji z anemią.
W przeciwieństwie do większości robaczyc jelitowych , gdzie największe obciążenia pasożytnicze występują u dzieci, częstość występowania i nasilenie tęgoryjców może być wyższa u dorosłych mężczyzn. Wyjaśnieniem tego jest to, że infekcja tęgoryjcem ma zwykle charakter zawodowy, więc współpracownicy i inne bliskie grupy utrzymują wysoką częstość infekcji między sobą poprzez zanieczyszczenie środowiska pracy. Jednak w większości obszarów endemicznych, dorosłe kobiety są najbardziej poważnie dotknięte przez anemię, głównie dlatego, że mają znacznie wyższe potrzeby fizjologiczne na żelazo (menstruacja, ciąża) .Ruch powtarzane interesującej konsekwencji tego w przypadku tęgoryjec dwunastnicy infekcji jest translactational transmisja infekcja: larwy tego gatunku inwazyjne dla skóry nie wszystkie natychmiast przechodzą przez płuca i dalej do jelit, ale rozprzestrzeniają się po całym ciele poprzez krążenie, aby stać się uśpione wewnątrz włókien mięśniowych. U kobiety w ciąży po porodzie część lub wszystkie z tych larw są stymulowane do ponownego wejścia do krążenia (prawdopodobnie przez nagłe zmiany hormonalne), a następnie do gruczołów sutkowych, dzięki czemu noworodek może otrzymać dużą dawkę larw zakaźnych przez mleko matki. To wyjaśnia niewytłumaczalne przypadki bardzo ciężkich, a nawet śmiertelnych infekcji tęgoryjcami u dzieci w wieku około miesiąca, w miejscach takich jak Chiny, Indie i północna Australia. Identyczne zjawisko jest znacznie częściej obserwowane w przypadku infekcji Ancylostoma caninum u psów, gdzie nowonarodzone szczenięta mogą nawet umrzeć z powodu krwotoku z jelit spowodowanego ogromną liczbą żerujących tęgoryjców. Odzwierciedla to również bliski ewolucyjny związek między pasożytami człowieka i psa, które prawdopodobnie mają wspólnego przodka, którego początki sięgają czasów, gdy ludzie i psy po raz pierwszy zaczęli żyć blisko siebie. Larwy nitkowate to zakaźne stadium pasożyta: infekcja występuje, gdy larwy w glebie wnikają w skórę lub gdy zostaną połknięte przez skażoną żywność i wodę po przeniknięciu przez skórę.
Diagnoza
Diagnoza polega na znalezieniu charakterystycznych jaj robaków na podstawie mikroskopowego badania stolca, chociaż nie jest to możliwe we wczesnej infekcji. Wczesne objawy infekcji u większości psów obejmują utykanie rąbka i swędzenie odbytu. Jaja są owalne lub eliptyczne, o wymiarach 60 na 40 µm, bezbarwne, nie zabarwione żółcią i z cienką przezroczystą błoną powłoki hialinowej . Po uwolnieniu przez robaka w jelicie jajo zawiera niesegmentowaną komórkę jajową . Podczas przechodzenia w dół jelita rozwija się komórka jajowa i w ten sposób jajeczka wydalane z kałem mają segmentową komórkę jajową, zwykle z 4 do 8 blastomerami . Ponieważ jaja zarówno Ancylostoma, jak i Necator (i większości innych gatunków tęgoryjców) są nie do odróżnienia, aby zidentyfikować rodzaj, należy je wyhodować w laboratorium, aby umożliwić wylęgnięcie się larw. Jeśli próbka kału zostanie pozostawiona na dzień lub dłużej w warunkach tropikalnych, larwy się wylęgną, więc jaja mogą nie być już widoczne. W takim przypadku istotne jest odróżnienie tęgoryjców od larw Strongyloides , ponieważ zakażenie tymi ostatnimi ma poważniejsze implikacje i wymaga innego postępowania. Larwy dwóch gatunków tęgoryjców można również odróżnić mikroskopowo, chociaż nie byłoby to wykonywane rutynowo, ale zwykle do celów badawczych. Dorosłe robaki są rzadko widywane (z wyjątkiem endoskopii, operacji lub autopsji), ale jeśli zostaną znalezione, umożliwi to ostateczną identyfikację gatunku. Klasyfikacji można dokonać na podstawie długości jamy policzkowej, przestrzeni między otworem ustnym a przełykiem: larwy tęgoryjców rabditoform mają długie jamy policzkowe, a larwy Strongyloides rhabditoform krótkie.
Ostatnie badania skupiły się na opracowaniu narzędzi opartych na DNA do diagnozowania infekcji, specyficznej identyfikacji tęgoryjców i analizy zmienności genetycznej w populacjach tęgoryjców. Ponieważ jaj tęgoryjców często nie da się odróżnić od jaj innych pasożytów, testy PCR mogą służyć jako podejście molekularne do dokładnej diagnozy tęgoryjca w kale.
Zapobieganie
Zakaźne larwy rozwijają się i przeżywają w środowisku wilgotnego brudu, szczególnie piaszczystej i gliniastej gleby. Nie mogą przetrwać w glinie lub błocie. Główne kierunki ostrożności to te podyktowane dobrymi zachowaniami higienicznymi :
- Nie wypróżniaj się na otwartej przestrzeni , ale raczej w toaletach .
- Nie stosować jako nawozu w rolnictwie nieoczyszczonych ludzkich odchodów lub nieoczyszczonych ścieków .
- Nie chodź boso po znanych zakażonych obszarach.
- Odrobaczanie psów i kotów. Tęgoryjce u psów i kotów rzadko rozwijają się u ludzi w dorosłość. Ancylostoma caninum , pospolita psia tęgoryjca, czasami rozwija się do postaci dorosłej, powodując eozynofilowe zapalenie jelit u ludzi, ale ich inwazyjne larwy mogą powodować swędzącą wysypkę zwaną skórną larwą wędrującą .
Moksydektyna jest dostępna w Stanach Zjednoczonych jako ( imidaklopryd + moksydektyna) roztwór do stosowania miejscowego dla psów i kotów. Wykorzystuje moksydektynę do zwalczania obleńców, tęgoryjców, nicieni sercowych i włosogłówek oraz zapobiegania im .
Dzieci
Większość z tych problemów dotyczących zdrowia publicznego koncentruje się na dzieciach zarażonych tęgoryjcem. Skupienie się na dzieciach wynika w dużej mierze z dużej liczby dowodów, które wykazały silne powiązania między infekcją tęgoryjcem a upośledzeniem uczenia się, zwiększoną nieobecnością w szkole i zmniejszoną przyszłą wydajnością ekonomiczną. W 2001 roku 54. Światowe Zgromadzenie Zdrowia uchwaliło rezolucję wzywającą państwa członkowskie do osiągnięcia minimalnego celu regularnego odrobaczania co najmniej 75% wszystkich zagrożonych dzieci w wieku szkolnym do 2010 roku. leczyć zagrożone dzieci w wieku szkolnym. Niektóre z interesujących statystyk były następujące: 1) tylko 9 ze 130 krajów endemicznych było w stanie osiągnąć cel 75%; oraz 2) osiągnięto mniej niż 77 milionów dzieci w wieku szkolnym (z łącznej liczby 878 milionów zagrożonych), co oznacza, że tylko 8,78% dzieci z grupy ryzyka jest leczonych na infekcję tęgoryjcem.
Masowe odrobaczanie w szkole
Szkolne programy masowego odrobaczania są najpopularniejszą strategią rozwiązania problemu infekcji tęgoryjcami u dzieci. Programy szkolne są niezwykle opłacalne, ponieważ szkoły mają już dostępną, rozległą i trwałą infrastrukturę z wykwalifikowaną siłą roboczą, która ma bliskie relacje ze społecznością. Przy niewielkim przeszkoleniu w lokalnym systemie opieki zdrowotnej nauczyciele mogą z łatwością podawać leki, które często kosztują mniej niż 0,50 USD na dziecko rocznie.
Ostatnio wiele osób zaczęło kwestionować, czy programy szkolne są koniecznie najskuteczniejszym podejściem. Ważnym problemem związanym z programami szkolnymi jest to, że często nie docierają one do dzieci, które nie chodzą do szkoły, ignorując w ten sposób dużą liczbę zagrożonych dzieci. Badanie przeprowadzone w 2008 r. przez Massę i in. kontynuowała debatę dotyczącą programów szkolnych. Zbadali skutki leczenia kierowanego przez społeczność w porównaniu z leczeniem szkolnym w regionie Tanga w Tanzanii. Głównym wnioskiem było to, że średnia intensywność infekcji tęgoryjcem była znacznie niższa w wioskach, w których stosowano podejście ukierunkowane na społeczność niż podejście szkolne. Model leczenia kierowanego przez społeczność wykorzystany w tym konkretnym badaniu pozwolił mieszkańcom wsi przejąć kontrolę nad leczeniem dziecka poprzez nakazanie mieszkańcom wsi wyboru własnych lokalnych dystrybutorów leków do podawania leków przeciwrobaczych. Dodatkowo mieszkańcy wsi zorganizowali i wdrożyli własne metody rozdawania narkotyków wszystkim dzieciom. Pozytywne wyniki związane z tym nowym modelem podkreślają potrzebę zaangażowania społeczności na dużą skalę w kampanie odrobaczania.
Edukacja w zakresie zdrowia publicznego
Wiele programów masowego odrobaczania łączy swoje wysiłki z edukacją w zakresie zdrowia publicznego. Te programy edukacji zdrowotnej często kładą nacisk na ważne techniki profilaktyczne, takie jak: mycie rąk przed jedzeniem i trzymanie się z dala od wody/obszarów skażonych ludzkim kałem. Programy te mogą również podkreślać, że buty muszą być noszone, jednak wiążą się one z własnym zagrożeniem dla zdrowia i mogą nie być skuteczne. Wzory noszenia butów w miastach i wsiach na całym świecie są determinowane przez przekonania kulturowe i poziom wykształcenia w tym społeczeństwie. Noszenie butów zapobiegnie przedostawaniu się infekcji tęgoryjcem z okolicznych gleb do delikatnych obszarów skóry; takie jak obszary między palcami.
Urządzenia sanitarne
Przykłady historyczne, takie jak kampanie tęgoryjców w Mississippi i na Florydzie w latach 1943-1947 pokazały, że główną przyczyną infekcji tęgoryjcami są złe warunki sanitarne, które można rozwiązać budując i konserwując toalety . Ale chociaż może się to wydawać prostymi zadaniami, wiążą się one z ważnymi wyzwaniami dla zdrowia publicznego. Większość zarażonych populacji pochodzi z obszarów dotkniętych ubóstwem o bardzo złych warunkach sanitarnych. Dlatego najprawdopodobniej zagrożone dzieci nie mają dostępu do czystej wody do mycia rąk i mieszkają w środowiskach bez odpowiedniej infrastruktury sanitarnej. Dlatego edukacja zdrowotna musi uwzględniać środki zapobiegawcze w sposób, który jest zarówno wykonalny, jak i trwały w kontekście środowisk o ograniczonych zasobach.
Zintegrowane podejścia
Ocena licznych interwencji w zakresie zdrowia publicznego generalnie wykazała, że poprawa w każdym indywidualnym elemencie zwykle przypisywanym ubóstwu (na przykład warunki sanitarne, edukacja zdrowotna i podstawowy stan odżywienia) często mają minimalny wpływ na przenoszenie. Na przykład jedno z badań wykazało, że wprowadzenie latryn do społeczności o ograniczonych zasobach zmniejszyło częstość infekcji tęgoryjcami tylko o 4%. Jednak inne badanie przeprowadzone w Salvadorze w Brazylii wykazało, że ulepszony drenaż i kanalizacja miały znaczący wpływ na częstość infekcji tęgoryjcami, ale nie miały żadnego wpływu na intensywność infekcji tęgoryjcami. Wydaje się to sugerować, że sama kontrola środowiska ma ograniczony, ale niepełny wpływ na przenoszenie tęgoryjców. Dlatego konieczne jest przeprowadzenie większej liczby badań w celu zrozumienia skuteczności i trwałości zintegrowanych programów, które łączą wiele metod profilaktycznych, w tym edukację, warunki sanitarne i leczenie.
Leczenie
Leki przeciwrobacze
Najczęstszym sposobem leczenia tęgoryjców są benzimidazole , w szczególności albendazol i mebendazol . BZA zabijają dorosłe robaki, wiążąc się z β- tubuliną nicieni, a następnie hamując polimeryzację mikrotubul wewnątrz pasożyta. W pewnych okolicznościach można użyć lewamizolu i embonianu pyrantelu . Przegląd z 2008 r. wykazał, że skuteczność jednodawkowych leków na infekcje tęgoryjców była następująca: 72% dla albendazolu, 15% dla mebendazolu i 31% dla embonianu pyrantelu. Potwierdza to wcześniejsze twierdzenia, że albendazol jest znacznie bardziej skuteczny niż mebendazol w przypadku infekcji tęgoryjcami. Warto również zauważyć, że Światowa Organizacja Zdrowia zaleca leczenie przeciwrobacze u kobiet w ciąży po pierwszym trymestrze ciąży. Zaleca się również, aby jeśli pacjent cierpi na anemię, siarczan żelaza (200 mg) był podawany trzy razy dziennie w tym samym czasie, co leczenie przeciwrobacze; powinno to być kontynuowane do czasu powrotu wartości hemoglobiny do normy, co może potrwać do 3 miesięcy.
Infekcję tęgoryjcem można leczyć miejscową krioterapią, gdy tęgoryjca nadal znajduje się w skórze.
Albendazol jest skuteczny zarówno na etapie jelitowym, jak i na etapie, w którym pasożyt nadal migruje pod skórą.
W przypadku niedokrwistości suplementacja żelaza może spowodować złagodzenie objawów niedokrwistości z niedoboru żelaza . Jednak wraz z przywróceniem poziomu czerwonych krwinek może wystąpić niedobór innych niezbędnych składników, takich jak kwas foliowy lub witamina B12 , więc można je również uzupełnić.
W latach 1910 powszechnie stosowane leki na tęgoryjce obejmowały tymol , 2-naftol , chloroform , benzynę i olejek eukaliptusowy . W latach czterdziestych w leczeniu z wyboru stosowano tetrachloroetylen , podawany w ilości 3-4 cm3 na czczo, a następnie 30 do 45 g siarczanu sodu . Doniesiono, że tetrachloroetylen ma 80 procent wyleczeń z infekcji Necator, ale 25 procent z infekcji Ancylostoma i często powoduje łagodne zatrucie u pacjenta.
Reinfekcja i lekooporność
Inne ważne kwestie związane z leczeniem tęgoryjców to reinfekcja i lekooporność. Wykazano, że reinfekcja po leczeniu może być bardzo wysoka. Niektóre badania pokazują nawet, że 80% przypadków zarażenia tęgoryjcami przed leczeniem można zaobserwować w leczonych społecznościach w ciągu 30-36 miesięcy. Chociaż może wystąpić reinfekcja, nadal zaleca się przeprowadzanie regularnych zabiegów, ponieważ zminimalizuje to występowanie przewlekłych skutków. Rosną również obawy dotyczące kwestii lekooporności. Oporność na leki pojawiła się w środkach przeciwrobaczych pierwszej linii stosowanych w przypadku nicieni hodowlanych. Generalnie nicienie ludzkie mają mniejsze prawdopodobieństwo rozwoju oporności ze względu na dłuższe czasy reprodukcji, rzadsze leczenie i bardziej ukierunkowane leczenie. Niemniej jednak społeczność globalna musi uważać, aby utrzymać skuteczność obecnych środków przeciwrobaczych, ponieważ żadne nowe leki przeciwrobacze nie znajdują się na późnym etapie rozwoju.
Epidemiologia
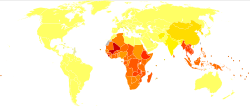
Szacuje się, że od 576 do 740 milionów osobników jest zarażonych tęgoryjcem. Spośród tych zarażonych osób około 80 milionów jest poważnie dotkniętych. Główną przyczyną infekcji tęgoryjcem jest N. americanus, który występuje w obu Amerykach, Afryce Subsaharyjskiej i Azji. A. duodenale występuje w bardziej rozproszonych środowiskach ogniskowych, a mianowicie w Europie i basenie Morza Śródziemnego. Większość zarażonych osobników koncentruje się w Afryce Subsaharyjskiej i Azji Wschodniej/Wyspach Pacyfiku, przy czym w każdym regionie szacuje się odpowiednio 198 milionów i 149 milionów zarażonych osobników. Inne dotknięte regiony to: Azja Południowa (50 mln), Ameryka Łacińska i Karaiby (50 mln), Azja Południowa (59 mln), Bliski Wschód/Afryka Północna (10 mln). Większość tych zarażonych osób żyje na obszarach dotkniętych biedą, o złych warunkach sanitarnych. Infekcja tęgoryjcem jest najbardziej skoncentrowana wśród najbiedniejszych na świecie, którzy żyją za mniej niż 2 dolary dziennie.
Chociaż infekcja tęgoryjcem może nie prowadzić bezpośrednio do śmiertelności, jej wpływ na zachorowalność wymaga natychmiastowej uwagi. Biorąc pod uwagę lata życia skorygowane niepełnosprawnością (DALY), zaniedbane choroby tropikalne, w tym infekcja tęgoryjcem, zaliczają się do chorób biegunkowych, choroby niedokrwiennej serca , malarii i gruźlicy jako jednych z najważniejszych problemów zdrowotnych krajów rozwijających się.
Szacuje się, że z powodu infekcji tęgoryjcem utracono aż 22,1 miliona DALY . Ostatnio rośnie zainteresowanie rozwiązywaniem problemów zdrowia publicznego związanych z infekcją tęgoryjcami. Na przykład Fundacja Billa i Melindy Gates niedawno przekazała 34 miliony dolarów na walkę z zaniedbanymi chorobami tropikalnymi, w tym z infekcją tęgoryjcem. Były prezydent USA Clinton ogłosił również wielkie zobowiązanie na dorocznym spotkaniu Clinton Global Initiative (CGI) 2008 do odrobaczenia 10 milionów dzieci.
Wiele danych liczbowych dotyczących częstości występowania tęgoryjców to dane szacunkowe, ponieważ nie istnieje obecnie żaden międzynarodowy mechanizm nadzoru, aby określić częstość występowania i globalną dystrybucję. Niektóre wskaźniki chorobowości zostały zmierzone na podstawie danych ankietowych w regionach endemicznych na całym świecie. Poniżej przedstawiono niektóre z najnowszych ustaleń dotyczących wskaźników rozpowszechnienia w regionach endemicznych z tęgoryjcem.
Darjeeling , Hooghly District , Bengal Zachodni , Indie (Pal i in. 2007)
- 43% przypadków zakażenia głównie N. americanus, chociaż z niektórymi zakażeniami A. duodenale
- Zarówno obciążenie infekcją tęgoryjcem, jak i stopień niedokrwistości w zakresie łagodnym
Wioska Xiulongkan , prowincja Hainan , Chiny (Gandhi i in. 2001)
- 60% wskaźnik infekcji głównie N. americanus
- Ważnymi zauważonymi trendami było to, że chorobowość wzrastała wraz z wiekiem (plateau około 41 lat), a kobiety miały wyższe wskaźniki chorobowości niż mężczyźni
Hoa Bình , północno-zachodni Wietnam (Verle et al. 2003)
- 52% z łącznej liczby 526 przebadanych gospodarstw domowych zakażonych
- Nie udało się zidentyfikować gatunku, ale wcześniejsze badania w Wietnamie Północnym wykazały obecność N. americanus w ponad 95% larw tęgoryjców
Minas Gerais , Brazylia (Fleming i in. 2006)
- 63% odsetek zakażeń głównie N. americanus
KwaZulu-Natal , Republika Południowej Afryki (Mabaso i in. 2004)
- Obszary śródlądowe miały wskaźnik występowania 9% N. americanus
- Na równinach przybrzeżnych wskaźnik rozpowszechnienia N. americanus wyniósł 63%
Hrabstwo Lowndes, Alabama , Stany Zjednoczone
- 35% wskaźnik infekcji głównie N. americanus
Dokonano również postępu technologicznego, który może ułatwić dokładniejsze mapowanie występowania tęgoryjców. Niektórzy badacze zaczęli używać systemów informacji geograficznej (GIS) i teledetekcji (RS) do badania ekologii i epidemiologii pasożytów. Brooker i in. wykorzystali tę technologię do stworzenia map rozmieszczenia robaków w Afryce subsaharyjskiej. Dzięki powiązaniu danych środowiskowych pochodzących z satelitów z danymi dotyczącymi częstości występowania z badań szkolnych, naukowcy byli w stanie stworzyć szczegółowe mapy częstości występowania. Badanie koncentrowało się na szerokiej gamie robaków, ale znaleziono interesujące wnioski dotyczące konkretnie tęgoryjców. W porównaniu z innymi robakami, tęgoryjce potrafią przetrwać w znacznie cieplejszych warunkach i były bardzo rozpowszechnione w górnej części zakresu termicznego.
Udoskonalone narzędzia diagnostyki molekularnej to kolejny postęp technologiczny, który może pomóc ulepszyć istniejące statystyki rozpowszechnienia. Ostatnie badania skupiły się na opracowaniu narzędzia opartego na DNA, które można wykorzystać do diagnozowania infekcji, specyficznej identyfikacji tęgoryjców i analizy zmienności genetycznej w populacjach tęgoryjców. Ponownie może to służyć jako główne narzędzie różnych środków ochrony zdrowia publicznego przeciwko infekcji tęgoryjcem. Większość badań dotyczących narzędzi diagnostycznych koncentruje się obecnie na stworzeniu szybkiego i niedrogiego testu do specyficznej diagnozy infekcji tęgoryjcami. Wielu ma nadzieję, że jego rozwój zostanie osiągnięty w ciągu najbliższych pięciu lat.
Historia
Odkrycie
Objawy obecnie przypisywane tęgoryjcom pojawiają się w dokumentach papirusowych starożytnego Egiptu (ok. 1500 pne), opisane jako zaburzenie charakteryzujące się anemią. Awicenna , perski lekarz z XI wieku, odkrył robaka u kilku swoich pacjentów i powiązał go z ich chorobą. W późniejszych czasach schorzenie to było zauważalnie powszechne w przemyśle wydobywczym w Anglii , Francji , Niemczech , Belgii , North Queensland i innych miejscach.
Włoski lekarz Angelo Dubini był współczesnym odkrywcą robaka w 1838 roku po sekcji zwłok pewnej wieśniaczki. Dubini opublikował szczegóły w 1843 i zidentyfikował gatunek jako A. duodenale . Pracując w egipskim systemie medycznym w 1852 r. niemiecki lekarz Theodor Bilharz , czerpiąc z pracy kolegi Wilhelma Griesingera , znalazł te robaki podczas sekcji zwłok i poszedł o krok dalej w powiązaniu ich z lokalnymi endemicznymi występowaniem chlorozy , którą prawdopodobnie nazwano by niedokrwistością z niedoboru żelaza . Dziś.
Przełom nastąpił 25 lat później po epidemii biegunki i anemii , która miała miejsce wśród włoskich robotników zatrudnionych przy tunelu kolejowym Świętego Gotarda . W artykule z 1880 roku lekarze Camillo Bozzolo , Edoardo Perroncito i Luigi Pagliani słusznie wysunęli hipotezę, że tęgoryjce były powiązane z faktem, że robotnicy musieli wypróżniać się w 15-kilometrowym tunelu i że wielu nosiło zużyte buty. Środowisko pracy często zawierało stojącą wodę, czasami sięgającą do kolan, a larwy były w stanie przetrwać kilka tygodni w wodzie, co pozwalało im zarazić wielu pracowników. W 1897 r. ustalono, że skóra jest główną drogą infekcji i wyjaśniono biologiczny cykl życiowy tęgoryjca.
Programy zwalczania
W 1899 amerykański zoolog Charles Wardell Stiles zidentyfikował postępującą anemię złośliwą obserwowaną w południowych Stanach Zjednoczonych jako wywoływaną przez tęgoryjca A. duodenale . Testy przeprowadzone w 1900 roku ujawniły bardzo silną infestację u dzieci w wieku szkolnym. W Portoryko dr Bailey K. Ashford, lekarz armii amerykańskiej, zorganizował i przeprowadził kampanię leczenia pasożytów, która wyleczyła około 300 000 ludzi (jedna trzecia populacji Portorykańczyków) i zmniejszyła śmiertelność z powodu tej anemii o 90 procent. w latach 1903-04.

26 października 1909 r. zorganizowano Komisję Sanitarną Rockefellera ds. Zwalczania Choroby Tęgoryjca w wyniku podarunku w wysokości 1 miliona dolarów od Johna D. Rockefellera , seniora. Pięcioletni program był niezwykłym sukcesem i wielkim wkładem w rozwój Zdrowie publiczne Stanów Zjednoczonych, wpajanie edukacji publicznej, leków, pracy w terenie i nowoczesnych rządowych departamentów zdrowia w jedenastu południowych stanach. Wystawa tęgoryjców była ważną częścią targów stanowych Mississippi w 1910 roku.
Komisja ustaliła, że średnio 40% dzieci w wieku szkolnym było zarażonych tęgoryjcem. Obszary o wyższym poziomie zarażenia tęgoryjcami przed programem eradykacji doświadczyły większego wzrostu liczby zapisów do szkół, frekwencji i umiejętności czytania i pisania po interwencji. Badania ekonometryczne wykazały, że efektu tego nie można wytłumaczyć różnymi alternatywnymi czynnikami, w tym różnicami tendencji w różnych obszarach, zmianami cen upraw, zmianami w niektórych politykach edukacyjnych i zdrowotnych oraz efektem eliminacji malarii. Nie znaleziono znaczących jednoczesnych wyników dla dorosłych, którzy powinni odnieść mniejsze korzyści z interwencji ze względu na ich znacznie niższy (wcześniej) wskaźnik infekcji. Program prawie wytępił tęgoryjca i rozkwitł później dzięki nowemu finansowaniu jako Międzynarodowy Wydział Zdrowia Fundacji Rockefellera .
Kampania tęgoryjca RF w Meksyku pokazała, jak nauka i polityka odgrywają rolę w opracowywaniu polityki zdrowotnej. Zgromadziła urzędników państwowych, urzędników służby zdrowia, pracowników publicznej służby zdrowia, urzędników Rockefellera i społeczność. Ta kampania została uruchomiona w celu wyeliminowania tęgoryjców w Meksyku. Chociaż kampania nie koncentrowała się na leczeniu długoterminowym, określiła warunki relacji między Meksykiem a Fundacją Rockefellera. Wiedza naukowa stojąca za tą kampanią pomogła ukształtować politykę zdrowia publicznego, poprawić zdrowie publiczne i zbudować silne relacje między Stanami Zjednoczonymi a Meksykiem.
W latach dwudziestych zwalczanie tęgoryjców dotarło do Karaibów i Ameryki Łacińskiej, gdzie pod koniec XVIII wieku odnotowano dużą śmiertelność wśród ludzi w Indiach Zachodnich , a także dzięki opisom nadesłanym z Brazylii i różnych innych regionów tropikalnych i subtropikalnych.
Zabiegi
Leczenie na początku XX wieku polegało na stosowaniu soli Epsom w celu zmniejszenia ochronnego śluzu, a następnie tymolu w celu zabicia robaków. W latach czterdziestych wiodącą metodą był tetrachloroetylen . Dopiero w połowie XX wieku opracowano nowe organiczne związki leków.
Badania
Niedokrwistość w ciąży
Szacuje się, że jedna trzecia wszystkich ciężarnych kobiet w krajach rozwijających się jest zarażona tęgoryjcem, 56% wszystkich ciężarnych kobiet w krajach rozwijających się cierpi na anemię, 20% wszystkich zgonów matek jest bezpośrednio lub pośrednio związanych z anemią. Takie liczby doprowadziły do zwiększonego zainteresowania tematem anemii związanej z tęgoryjcami w czasie ciąży. Zdając sobie sprawę, że przewlekła infekcja tęgoryjcem często prowadzi do anemii, wiele osób kwestionuje obecnie, czy leczenie tęgoryjców może wpłynąć na zmianę wskaźników ciężkiej anemii, a tym samym również na zdrowie matki i dziecka. Większość dowodów sugeruje, że udział tęgoryjców w anemii matek zasługuje na to, aby wszystkie kobiety w wieku rozrodczym mieszkające na terenach endemicznych były poddawane okresowemu leczeniu przeciwrobaczemu. Światowa Organizacja Zdrowia zaleca nawet leczenie zarażonych kobiet w ciąży po pierwszym trymestrze ciąży. Niezależnie od tych sugestii tylko Madagaskar, Nepal i Sri Lanka dodały odrobaczanie do swoich programów opieki przedporodowej.
Ten brak odrobaczania kobiet w ciąży tłumaczy się tym, że większość osób nadal obawia się, że leczenie przeciwrobacze spowoduje niekorzystne skutki porodu. Ale badanie przeprowadzone w 2006 roku przez Gyorkos et al. odkryli, że porównując grupę ciężarnych kobiet leczonych mebendazolem z kontrolną grupą placebo, obie ilustrowały raczej podobne wskaźniki niekorzystnych wyników porodu. Grupa leczona wykazała 5,6% niekorzystnych skutków porodu, podczas gdy grupa kontrolna miała 6,25% niekorzystnych skutków porodu. Ponadto Larocque i in. ilustruje, że leczenie infekcji tęgoryjcem faktycznie doprowadziło do pozytywnych wyników zdrowotnych u niemowlęcia. Badanie to wykazało, że leczenie mebendazolem i suplementami żelaza podczas opieki przedporodowej znacznie zmniejszyło odsetek niemowląt o bardzo niskiej masie urodzeniowej w porównaniu z grupą kontrolną placebo. Dotychczasowe badania potwierdziły zalecenia dotyczące leczenia zarażonych kobiet w ciąży z powodu infekcji tęgoryjcem podczas ciąży.
Przegląd wykazał, że pojedyncza dawka środków przeciwrobaczych (leków przeciwrobaczych) podana w drugim trymestrze ciąży „może zmniejszyć niedokrwistość u matki i częstość występowania robaków, gdy jest stosowana w warunkach wysokiej częstości występowania robaczycy u matki”.
Intensywność infekcji tęgoryjcem, a także gatunek tęgoryjca nie zostały jeszcze zbadane, ponieważ odnoszą się one do anemii związanej z tęgoryjcami w czasie ciąży. Ponadto należy przeprowadzić więcej badań w różnych regionach świata, aby sprawdzić, czy trendy odnotowane w ukończonych badaniach utrzymują się.
Współzakażenie malarią
Współzakażenie tęgoryjcem i Plasmodium falciparum jest powszechne w Afryce. Chociaż dokładne liczby nie są znane, wstępne analizy szacują, że nawet jedna czwarta afrykańskich dzieci w wieku szkolnym (17,8–32,1 mln dzieci w wieku 5–14 lat) może być przypadkowo zagrożona zarówno P. falciparum, jak i tęgoryjcem. Podczas gdy pierwotne hipotezy stwierdzały, że współzakażenie wieloma pasożytami osłabiłoby odpowiedź immunologiczną gospodarza na jednego pasożyta i zwiększyłoby podatność na chorobę kliniczną, badania przyniosły odmienne wyniki. Na przykład jedno badanie w Senegalu wykazało, że ryzyko klinicznej infekcji malarią było zwiększone u dzieci zakażonych robakami w porównaniu z dziećmi wolnymi od robaków, podczas gdy inne badania nie odtworzyły takich wyników, a nawet wśród eksperymentów na myszach laboratoryjnych wpływ robaków na malaria jest zmienna.
Niektóre hipotezy i badania sugerują, że zakażenia robakami pasożytniczymi mogą chronić przed malarią mózgową ze względu na możliwą modulację odpowiedzi cytokin prozapalnych i przeciwzapalnych. Co więcej, mechanizmy leżące u podstaw tej rzekomej zwiększonej podatności na choroby są nieznane. Na przykład infekcje helmintowe powodują silną i wysoce spolaryzowaną odpowiedź immunologiczną charakteryzującą się zwiększoną produkcją cytokin limfocytów T pomocniczych typu 2 (T h 2) i immunoglobulin E (IgE). Jednak wpływ takich odpowiedzi na ludzką odpowiedź immunologiczną jest nieznany. Ponadto zarówno malaria, jak i infekcja robakami pasożytniczymi mogą powodować anemię, ale efekt koinfekcji i ewentualnego nasilenia niedokrwistości jest słabo poznany.
Hipoteza higieniczna i tęgoryjce jako terapia
W hipoteza higieniczna stwierdza, że niemowlęta i dzieci, którym brak narażenia na czynniki zakaźne są bardziej podatne na choroby alergiczne poprzez modulowanie rozwoju układu odpornościowego. Teoria ta została po raz pierwszy zaproponowana przez Davida P. Strachana, który zauważył, że katar sienny i egzema występowały rzadziej u dzieci należących do rodzin wielodzietnych. Od tego czasu badania wykazały wpływ robaków żołądkowo-jelitowych na rozwój alergii w krajach rozwijających się. Na przykład badanie w Gambii wykazało, że wytępienie robaków w niektórych wioskach doprowadziło do nasilenia reakcji skórnych na alergie wśród dzieci.
Szczepionki
Chociaż coroczne lub półroczne masowe podawanie środków przeciwrobaczych jest krytycznym aspektem każdej interwencji w zakresie zdrowia publicznego, wiele osób zaczęło zdawać sobie sprawę, jak niezrównoważone jest to ze względu na takie aspekty, jak ubóstwo, wysokie wskaźniki ponownego zakażenia i zmniejszona skuteczność leków przy wielokrotnym stosowaniu . Dlatego obecne badania skupiają się na opracowaniu szczepionki, którą można by włączyć do istniejących programów kontroli. Celem opracowania szczepionki niekoniecznie jest stworzenie szczepionki o sterylizującej odporności lub całkowitej ochronie przed odpornością. Szczepionka, która zmniejsza prawdopodobieństwo wystąpienia ciężkich infekcji u zaszczepionych osób, a tym samym obniży poziom krwi i składników odżywczych, może nadal mieć znaczący wpływ na wysokie obciążenie chorobami na całym świecie.
Obecne badania koncentrują się na dwóch etapach rozwoju robaka: stadium larwalnym i stadium dorosłym. Badania nad antygenami larwalnym koncentrowały się na białkach należących do nadrodziny białek związanych z patogenezą , białek wydzielanych przez Ancylostoma . Chociaż po raz pierwszy zostały opisane w Anyclostoma , białka te zostały również pomyślnie wyizolowane z wydzielanego produktu N. americanus . N. americanus ASP-2 (Na-ASP-2) jest obecnie wiodącym kandydatem na szczepionkę przeciwko tęgoryjcom w stadium larwalnym. Przeprowadzono już randomizowane, podwójnie zaślepione, kontrolowane placebo badanie; 36 zdrowych dorosłych bez historii infekcji tęgoryjcami otrzymało trzy domięśniowe wstrzyknięcia trzech różnych stężeń Na-ASP-2 i obserwowano przez sześć miesięcy po ostatnim szczepieniu. Szczepionka wywołała znaczącą odpowiedź immunologiczną anty-Na-ASP-2 IgG i komórkową. Ponadto był bezpieczny i nie powodował wyniszczających skutków ubocznych. Szczepionka znajduje się obecnie w fazie pierwszej próby; zdrowym dorosłym ochotnikom z udokumentowanymi dowodami wcześniejszego zakażenia w Brazylii podaje się takie samo stężenie dawki według tego samego schematu, jak w początkowym badaniu. Jeśli to badanie zakończy się sukcesem, następnym krokiem będzie przeprowadzenie badania fazy drugiej w celu oceny szybkości i intensywności infekcji tęgoryjcem wśród zaszczepionych osób. Ponieważ szczepionka Na-ASP-2 jest ukierunkowana tylko na stadium larwalne, ważne jest, aby wszystkie osoby włączone do badania były leczone lekami przeciw robakom w celu wyeliminowania dorosłych robaków przed szczepieniem.
Dorosłe antygeny tęgoryjca również zostały zidentyfikowane jako potencjalni kandydaci do szczepionek. Kiedy dorosłe robaki przyczepiają się do błony śluzowej jelita żywiciela ludzkiego, dochodzi do rozerwania erytrocytów w przewodzie pokarmowym robaka, co powoduje uwolnienie wolnej hemoglobiny, która jest następnie rozkładana przez kaskadę proteolityczną. Kilka z tych białek, które są odpowiedzialne za tę kaskadę proteolityczną, ma również zasadnicze znaczenie dla odżywiania i przetrwania robaka. Dlatego szczepionka, która może indukować przeciwciała przeciwko tym antygenom, może zakłócać szlak trawienny tęgoryjca i utrudniać przeżycie robaka. Zidentyfikowano trzy białka: proteaza asparaginowa-hemoglobinaza APR-1, proteaza cysteinowa-hemoglobinaza CP-2 i transferaza S-glutationowa. Szczepienie APR-1 i CP-2 doprowadziło do zmniejszenia utraty krwi żywiciela i liczby jaj w kale u psów. W przypadku APR-1 szczepienie doprowadziło nawet do zmniejszenia obciążenia robakami. Badania są obecnie hamowane nad opracowaniem co najmniej jednego z tych antygenów jako białka rekombinowanego do testowania w badaniach klinicznych.
Terminologia
Termin „tęgoryjca” jest czasami używany w odniesieniu do infekcji tęgoryjcem. Tęgoryjec to rodzaj robaka pasożytniczego ( helminth ).
Zobacz też
Bibliografia
Zewnętrzne linki
- CDC Zakład Chorób Pasożytniczych obrazy cyklu życiowego tęgoryjca
- Centra Kontroli i Zapobiegania Chorobom
- Psi tęgoryjca ( Ancylostoma caninum ) w MetaPathogen: fakty, cykl życia, referencje
- Ludzkie tęgoryjce ( Ancylostoma duodenale i Necator americanus ) w MetaPathogen: fakty, cykl życiowy, referencje
| Klasyfikacja |
|---|